Fosforibosilformilglicinamidina ciclo-ligase
A fosforibosilformilglicinamidina ciclo-ligase (AIR sintetase ou FGAM ciclase) é a quinta enzima que participa na síntese de novo dos nucleotídeos de purina. Catalisa a reação na qual a 2-(formamido)-N1-(5-fosfo-β-D-ribosil)acetamidina (também chamado formilglicinamida-ribonucleotíde, FGAM) é convertida em 5-amino-1-(5-fosfo-β-D-ribosil)imidazol (conhecido também como 5-aminoimidazol ribonucleotídeo, AIR).
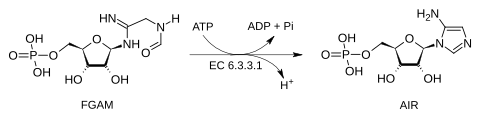
Esta reação fecha sobre si mesma a cadeia de FGAM para produzir um anel imidazol de cinco membros, que logo formará o núcleo das purinas. A AIR sintetase catalisa a transferência do oxigênio do grupo formila até o fosfato inorgânico.
O mecanismo é sequencial, a ATP se une à enzima em primeiro lugar e o ADP é o último a ser liberado. A hidrólise de ATP é utilizada para ativar o oxigênio do grupo amida com o objetivo de que o nitrogênio lhe efetue um ataque nucleofílico. Nos seres humanos, e em muitos outros organismos esta atividade catalítica está contida dentro do polipéptido chamado proteína adenosina-3 biossintética de purina trifuncional.
Nomenclatura[editar | editar código-fonte]
O nome sistemático desta classe de enzimas é 2-(formamido)-N1-(5-fosforibosil)acetamidina ciclo-ligase (formadora de ADP). Outros nomes de uso comum poden ser: AIR sintetase, 5'-aminoimidazol ribonucleotídeo sintetase, 2-(formamido)-1-N-(5-fosforribosil)acetamidina ciclo-ligase (formadora de ADP), fosforribosilaminoimidazol sintetase, e fosforribosilformilglicinamidins ciclo-ligase.
Síntese de purinas[editar | editar código-fonte]
As purinas são um dos dois tipos de bases heterocíclicas nitrogenadas, as quais, por sua vez, são um dos três componentes dos nucleotídeos que formam os ácidos nucleicos. A síntese das purinas pode ser realizada partindo praticamente do zero de novo; ou por meio de um mecanismo de reciclagem. A AIR sintetase forma parte da rota de síntese de novo. O primeiro passo desta rota metabólica começa com fosforribosil pirofosfato (PRPP) e o produto final é monofosfato de inosina (inosina monofosfato, IMP). O IMP, eventualmente, termina sendo convertido em AMP ou GMP. A estrutura do anel de purina vai sendo composto pela adição sucessiva de um ou dois átomos a um extremo do anel de ribose. A via de síntese de novo se encontra muito conservada na maioria dos organismos.
AIR sintetase de feijão-frade[editar | editar código-fonte]
A AIR sintetase é encontrada tanto en mitocondrias como em plastos; a forma mitocondrial possui 5 aminoácidos a mais que a forma plastidial.[1] No feijão-frade (Vigna unguiculata) a enzima é codificada por um único gene, apesar de existir em ambas as formas, plastidial e mitocondrial. Isso sugere que as diferentes versões da enzima podem ser derivadas de um único transcrito primário. Um estudo propõe que haja o controle estrito do gene pur5, o gene que codifica a AIR sintetase. [2]
Referências
- ↑ Goggin DE, Lipscombe R, Fedorova E, Millar AH, Mann A, Atkins CA, Smith PM (março de 2003). «Dual Intracellular Localization and Targeting of Aminoimidazole Ribonucleotide Synthetase in Cowpea». Plant Physiol. 131 (3): 1033–41. PMC 166869
 . PMID 12644656. doi:10.1104/pp.102.015081
. PMID 12644656. doi:10.1104/pp.102.015081
- ↑ Smith PM, Mann AJ, Goggin DE, Atkins CA (abril de 1998). «AIR synthetase in cowpea nodules: a single gene product targeted to two organelles?». Plant Mol. Biol. 36 (6): 811–20. PMID 9520274. doi:10.1023/A:1005969830314

