Fosfato
| Fosfato Alerta sobre risco à saúde | |
|---|---|
| |
|

|
| Nome sistemático | Fosfato[1] |
| Identificadores | |
| Número CAS | |
| PubChem | |
| ChemSpider | |
| MeSH | |
| ChEBI | |
| SMILES |
|
| Referência Beilstein | 3903772 |
| Referência Gmelin | 1997 |
| Propriedades | |
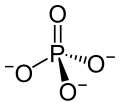
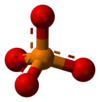
| Fórmula molecular | PO3− 4 |
| Massa molar | 94.9714 g mol−1 |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
Na química, um fosfato é um íon poliatômico ou um radical consistindo de um átomo de fósforo e quatro de oxigênio. Na forma iônica, tem a carga formal de -3, sendo denotado como PO43-.
No campo bioquímico, um íon de fosfato livre em solução é chamado de fosfato inorgânico, para distinguí-lo dos fosfatos existentes nas moléculas de trifosfato de adenosina (ATP), DNA ou mesmo RNA. Fosfato inorgânico é denotado geralmente como Pi. Fosfato inorgânico pode ser formado pelas reações de ATP ou adenosina difosfato (ADP), com a formação do ADP ou AMP correspondente e a liberação de um íon de fosfato. Reações similares existem para outros nucleosídeos difosfatos e trifosfatos.
Em sistemas vivos, íons de fosfato podem ser criados pela hidrólise de um íon maior chamado pirofosfato, o qual tem a estrutura P2O74 -, sendo denotado PPi.
- P2O74 - + H2O → 2HPO42-
Energia é armazenada pelas ligações do fosfato na forma de ADP ou ATP, ou outro nucleosideo difosfato ou trifosfato no tecido muscular. Esse fosfato é referido como fosfato de alta energia.
Em mineralogia e geologia, refere-se a uma rocha ou pepita contendo íons de fosfato.
Numericamente a classe de minerais fosfatos é o segundo maior grupo de minerais, ficando atrás apenas do grupo dos silicatos, a maior parte dos minerais desta classe são considerados minerais raros ou relativamente raros, e apesar do grande número de minerais, os fosfatos comuns são cerca de 35 minerais, sendo os mais comuns os minerais do grupo da apatita.[2]
Na mineralogia, o grupo dos fosfatos é um grupo de minerais onde o ânion coordenador e centralizador da estrutura são os grupos aniônicos [PO4]3-, [AsO4]3- e [VO4]3- (agrupando subgrupos titulados respectivamente de fosfatos, arsenatos e vanadatos), são classificados segundo o sistema de classificação de Strunz, onde nesta classificação temos as divisões 8A, 8B, 8C, 8D, 8E e 8F, são classificados como ligados a metais, não metais, outros grupos aniônicos e/ou íons complementares e água (H2O). Como curiosidade, os fosfatos constituem recursos minerais de grande importância econômica, sendo a principal fonte de fertilizantes.
Entre os fosfatos comuns ou de importância econômica, as suas características gerais são:
- minerais de dureza D < 5 (apenas 12 minerais possuem dureza entre 5 e 6).
- minerais pesados a muito pesados (a grande maioria possui densidade entre 2,9 g/cm3 e 4 g/cm3).
- minerais transparentes a translúcidos.
- minerais de traço branco (apenas alguns possuem cores distintas do branco).
- minerais de brilho não metálico, apenas a tyuyamunita possui brilho adamantino.
Mineral Fosfato: Apatita[3][editar | editar código-fonte]
| Fórmula | Ca5(PO4)3(Cl/F/OH). |
| Luminescência | Não fluorescente. |
| Composição | cálcio, fósforo, hidrogênio, cloro, oxigênio e flúor. |
| Formas | ( 0 1 1); ( 0 1 0); ( 0 0 1). |
| Classe | Bipiramidal hexagonal. |
| Cor | branco, verde, amarelo, vermelho e azul. |
| Classificação | 8B. |
Na agricultura, fosfato se refere a um dos três nutrientes primários das plantas, e é um componente dos fertilizantes. O fosfato é extraído de depósitos de rocha sedimentária e tratado quimicamente para aumentar a sua concentração e torná-lo mais solúvel, o que facilita sua absorção pelas plantas. O fosfato sem tratamento, apenas pulverizado, é normalmente utilizado em cultivo orgânico.
Os maiores depósitos de fosfato na América do Norte ficam na Carolina do Norte e na Flórida. O maior depósito do mundo fica em Nauru, que costumava ter o fosfato de melhor qualidade.
O fosfato também pode ser utilizado como agente de redução de dureza da água em detergentes. Esse uso é restrito devido à possibilidade de poluição de rios e mananciais.
Em termos ecológicos, o fosfato é muitas vezes o reagente limitante de muitos ambientes: a disponibilidade de fosfato governa a taxa de crescimento de muitos organismos. A introdução artificial de fosfato nestes ambientes pode causar um desequilíbrio ecológico, resultando na superpopulação de alguns organismos, os quais consomem também outros nutrientes e elementos essenciais. Desta forma organismos que não são diretamente favorecidos pela maior disponibilidade de fosfato sofrerão uma drástica redução em sua população, devido à falta de nutrientes e elementos essenciais.
Como exemplo, podemos citar que o fosfato utilizado em cultivos fertilizados e em produtos detergentes pode causar a poluição de rios e mananciais, resultando na superpopulação de algas de superfície, os quais diminuem o teor de oxigênio dissolvido na água. Sem oxigênio, a fauna aquática sofre consequências diretas, podendo resultar até na morte de peixes em massa.
Produção mundial[editar | editar código-fonte]
| 1. | 95,0 | |
| 2. | 35,5 | |
| 3. | 23,0 | |
| 4. | 13,1 | |
| 5. | 9,2 | |
| 6. | 6,5 | |
| 7. | 5,0 | |
| 8. | 4,7 | |
| 9. | 4,6 | |
| 10. | 4,1 |
Fonte: USGS.
Ver também[editar | editar código-fonte]
Referências
- ↑ «Phosphates – PubChem Public Chemical Database». The PubChem Project. USA: National Center of Biotechnology Information
- ↑ KLEIN e DUTROW, CORNELIS e BARBARA (2012). Manual de Ciência dos Minerais. PORTO ALEGRE: BOOKMAN
- ↑ NICK,, G. «CHEMTUBE3D». Consultado em 18 de novembro de 2022

