Nitreto de silício
| Nitreto de silício Alerta sobre risco à saúde | |
|---|---|

| |
| Outros nomes | Nierite |
| Identificadores | |
| Número CAS | |
| PubChem | |
| Número EINECS | |
| ChemSpider | |
| MeSH | |
| SMILES |
|
| InChI | 1S/N4Si3/c1-5-2-6(1)3(5)7(1,2)4(5)6
|
| Propriedades | |
| Fórmula química | N4Si3 |
| Massa molar | 140.28 g mol-1 |
| Aparência | cinza, pó inodoro |
| Densidade | 3.44 g/cm3, solido |
| Ponto de fusão |
1900 °C, 2173 K, 3452 °F (Decompõe-se) |
| Índice de refracção (nD) | 2.016[1] |
| Riscos associados | |
| Classificação UE | not listed |
| Compostos relacionados | |
| Outros aniões/ânions | Carboneto de silício, Dióxido de silício |
| Outros catiões/cátions | Nitreto de carbono |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
Nitreto de silício (Si3N4) é um composto químico de silício e nitrogênio. É uma cerâmica de alta resistência em uma ampla faixa de temperatura, condutividade térmica moderada, baixo coeficiente de dilatação térmica, possui também propriedades de elasticidade e tenacidade moderadamente altas se tratando de uma cerâmica. Esta combinação de propriedades em uma cerâmica leva à uma excelente resistência ao choque térmico, capacidade de suportar altas cargas estruturais e temperaturas, e resistência ao desgaste. O nitreto de silício é usado principalmente em aplicações de alta resistência e alta temperatura, tais como turbinas a gás, peças de motores de carro, rolamentos e ferramentas para trabalhar com o corte de metais. Rolamentos de nitreto de silício são usados nos motores principais dos ônibus espaciais da NASA. Filmes finos de nitreto de silício são uma camada isolante populares equipamentos eletrônicos baseados em silício. Ele também compõe o modilhão em microscópios de força atômica.
O nitreto de silício foi produzido pela primeira vez em 1857 por Deville e Wohler mas sua produção comercial ativa começou apenas em 1950. Na natureza, Si3N4 foi encontrado na década de 1990 como minúsculas inclusões em meteoritos, e foi nomeado nierite pelo físico americano Alfred OC Nier.
Historia[editar | editar código-fonte]
O nitreto de silício foi produzido pela primeira vez em 1857 por Henri Etienne Sainte-Claire Deville e Wöhler Friedrich,[2][3] mas permaneceu apenas como uma curiosidade química. Demorou quase uma centena de anos antes de ser usado. Em 1958, o nitreto de silício já se encontrava na produção comercial de tubos termopar, tubeiras de foguetes, barcos e cadinhos de metais de fusão. O trabalho britânico com nitreto de silício, iniciado em 1953, destinava-se para turbinas a gás em altas temperaturas e resultou no desenvolvimento de outros compostos de nitreto de silício. Em 1971, a Agência do Projeto de Pesquisa Avançada do Departamento de Defesa dos EUA firmou um contrato de 17 milhões dólares EUA com a Ford e a Westinghouse por duas turbinas a gás de cerâmica.[4]
Mesmo que as propriedades do nitreto de silício eram bem conhecidas, a sua ocorrência natural foi descoberta apenas na década de 1990, como pequenas inclusões (cerca de 2 × 0,5 microns de tamanho) em meteoritos. O mineral foi nomeado nierite por um pioneiro da espectrometria de massa Alfred OC Nier.[5] Este mineral pode ter sido detectado mais cedo, mais uma vez exclusivamente em meteoritos, por geólogos soviéticos.[6]
Síntese[editar | editar código-fonte]
O nitreto de silício pode ser obtido por reação direta entre silício e nitrogênio em temperaturas entre 1300 e 1400 °C:[3]
- 3 Si(s) + 2 N2(g) → Si3N4(s)
- SiCl4(l) + 6 NH3(g) → Si(NH)2(s) + 4 NH4Cl(s) em 0 °C
- 3 Si(NH)2(s) → Si3N4(s) + N2(g) + 3 H2(g) at 1000 °C
Ou por redução carbotérmica em atmosfera de nitrogênio em 1400-1450 °C:[3]
- 3 SiO2(s) + 6 C(s) + 2 N2(g) → Si3N4(s) + 6 CO(g)
A nitração de silício em pó foi desenvolvida na década de 1950, após a "redescoberta" do nitreto de silício e foi o melhor método para produção em larga escala do composto. Entretanto, o uso de silício bruto de baixa pureza causa a contaminação de nitreto de silício por silicatos e ferro. A decomposição do Diazeno resulta em nitreto de silício amorfo, que precisa ser recozido sob atmosfera de nitrogênio em 1400-1500 °C para convertê-la em um pó cristalino, que é agora a segunda rota mais importante para a produção comercial. A redução carbotérmica foi o primeiro método utilizado para produção de nitreto de silício e é agora considerado como a rota mais rentável industrial de alta pureza em pó de Si3N4.[3]
Filmes de Si3N4 em grau eletrônico são formados usando deposição de vapor químico (CVD), ou uma de suas variantes, como a deposição de vapor químico aprimorada por plasma(PECVD):[3][7]
- 3 SiH4(g) + 4 NH3(g) → Si3N4(s) + 12 H2(g)
- 3 SiCl4(g) + 4 NH3(g) → Si3N4(s) + 12 HCl(g)
- 3 SiCl2H2(g) + 4 NH3(g) → Si3N4(s) + 6 HCl(g) + 6 H2(g)
Para a deposição de camadas de nitreto de silício sobre substratos de semicondutores (geralmente silício), dois métodos são utilizados:[7]
- Deposição de vapor químico sob baixa pressão (LPCVD), que trabalha em altas temperaturas e é feito na vertical ou em um forno tubular horizontal[8] ou
- Deposição de vapor químico aprimorada por plasma (PECVD), que trabalha em baixas temperaturas em condições de vácuo.[9]
Nanofios de nitreto de silício também podem ser produzidos por sol-gel utilizando o método de redução carbotérmica seguido por nitração de sílica gel, que contém partículas ultrafinas de carbono. As partículas podem ser produzidas pela decomposição de dextrose na faixa de temperatura 1200-1350 °C. As reações de síntese possíveis são:[10]
- SiO2(s) + C(s) → SiO(g) + CO(g) e
- 3 SiO(g) + 2 N2(g) + 3 CO(g) → Si3N4(s) + 3 CO2(g) ou
- 3 SiO(g) + 2 N2(g) + 3 C(s) → Si3N4(s) + 3 CO(g).
Processamento[editar | editar código-fonte]
O nitreto de silício é difícil de produzir como um material a granel, não agüenta temperaturas superiores a 1.850 °C, que é bem abaixo do seu ponto de fusão, devido à dissociação do silício e nitrogênio. Portanto, a aplicação de técnicas convencionais de sinterização em altas temperaturas é problema. A ligação do pó de nitreto de silício pode ser conseguida a temperaturas mais baixas através da adição de materiais adicionais (auxiliares de sinterização ou "pastas"), que normalmente induzem um grau de sinterização por fase líquida.[11]]. A alternativa mais limpa é a utilização de sinterização por faíscas de plasma onde o aquecimento é conduzido muito rapidamente (segundos), passando pulsos de corrente elétrica através do pó compactado. Os compostos compactados de nitreto de silício foram obtidos por esta técnica em temperaturas de 1500-1700 °C.[12][13]
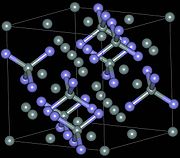
Estruturas cristalinas[editar | editar código-fonte]
| Os átomos azuis são de nitrogênio, os de cinza, silício | |||||||||
| |||||||||
Existem três estruturas cristalográficas de nitreto de silício (Si3N4), designado como α, β e γ .[14] As fases α e β são as formas mais comuns de Si3N4, e podem ser produzidas sob condição de pressão normal. A fase γ só pode ser sintetizada sob altas pressões e temperaturas e tem uma dureza de 35 GPa.[15][16]
O α-β-Si3N4 possui estruturas triangulares e hexagonais. Eles podem consistir em camadas de silício e nitrogênio com seqüência atômica ABAB... ou ABCDABCD ... em β-Si3N4 e α-Si3N4, respectivamente. A camada de AB é a mesma nas fases α e β, e a camada de CD, na fase α está relacionado à AB por um plano-c. O tetraedro de Si3N4 em β-Si3N4 está interligado de tal forma que os túneis são formados, correndo em paralelo com o eixo c da célula unitária. Devido ao plano-c que relaciona AB para CD, a estrutura α contém cavidades em vez de túneis.[13]
Quanto mais tempo de empilhamento na fase-α maior será dureza se comparado fase-β. No entanto, a fase-α é quimicamente instável comparado com a fase-β. Em altas temperaturas, quando uma fase líquida estiver presente, a fase-α sempre se transforma na faseβ. Portanto, β-Si3N4 é a principal forma utilizada na cerâmica Si3N4.[17]
Aplicações[editar | editar código-fonte]

Em geral, o principal problema com as aplicações de nitreto de silício não tem sido o desempenho técnico, mas sim o custo. Mas atualmente, com a queda do custo do produto, o número de aplicações de produção está acelerando.[18]
Industria automobilística[editar | editar código-fonte]
Uma das principais aplicações do nitreto de silício é na indústria automobilística como um material para as peças do motor. Estas incluem, nos motores Diesel, glowplugs para dar partida no motor mais rápido; câmaras de pré-combustão (câmaras de turbulência) para reduzir as emissões, e dar partida rapidamente; turbos para aumentar a aceleração do motor e reduzir as emissões. Em motores de ignição comandada, o nitreto de silício é usado em almofadas balancim para menor desgaste, e em válvulas de controle de gases de escape para aumentar a aceleração. Como exemplos de níveis de produção, há um número estimado de mais de 300.000 turbos de nitreto de silício feitas anualmente.[3][11][18]
Rolamentos[editar | editar código-fonte]

Cerâmicas de nitreto de silício têm boa resistência ao choque em comparação com outras cerâmicas. Portanto, rolamentos e esferas de cerâmica de nitreto de silício são usadas nos rolamentos de desempenho. Um exemplo representativo é o uso de rolamentos de nitreto de silício nos principais motores dos ônibus espaciais da NASA.[19][20]
Rolamentos de nitreto de silício são mais duros do que o metal que reduz o contato com a pista de rolamento. Isso resulta em ate 80% a menos de atrito, 3 a 10 vezes maior durabilidade, velocidade 80% maior, peso 60% mais leve, a capacidade de operar sem lubrificação, maior resistência à corrosão e maior temperatura de operação, em comparação com rolamentos de metal tradicional.[11] As Bolas de nitreto de silício pesam 79% menos do que bolas de carboneto de tungstênio. Rolamentos de nitreto de silício podem ser encontrados em automóveis de ponta, equipamentos industriais, turbinas eólicas, motores, bicicletas, patins e skates. Rolamentos de nitreto de silício são especialmente úteis em aplicações onde a corrosão, campos elétricos ou magnéticos podem proibir o uso de metais. Por exemplo, em medidores de vazão da maré, onde o ataque da água do mar é um problema.
Si3N4 foi demonstrada pela primeira vez como um rolamento superior em 1972, mas não chegou a produção até cerca de 1990 por causa de desafios associados com a redução do custo. Desde 1990, o custo foi reduzido substancialmente o volume de produção aumentou. Apesar dos rolamentos de nitreto de silício ainda estarem 2-5 vezes mais caro do que os rolamentos de aço, seu desempenho superior e vida estão justificando a rápida adoção. Cerca de 15 e 20 milhões de rolamentos foram produzidas no EUA para uso geral. O crescimento é estimado em 40% ao ano, mas poderia ser ainda maior se os rolamentos de cerâmica forem selecionados para aplicações de consumo, como patins e unidades de disco de computador[18]
Materiais de Alta-temperatura[editar | editar código-fonte]

O nitreto de silício tem sido muito utilizado em aplicações de alta temperatura. Em particular, ele foi identificado como um dos poucos materiais cerâmicos monolíticos capazes de sobreviver ao severo choque térmico e gradientes térmicos gerados em motores de foguete. Para demonstrar essa capacidade em uma configuração complexa, os cientistas da NASA utilizaram a tecnologia de prototipagem rápida avançadas para fabricar um componente de uma polegada de diâmetro, câmara de combustão de peça única / bico (propulsor). O propulsor foi testado com sob altas temperaturas com hidrogênio e oxigênio e sobreviveu a cinco ciclos, incluindo um ciclo de 5 minutos a uma temperatura de 1320 °C.[21]
Manipulação de metais e ferramentas de corte[editar | editar código-fonte]
A primeira grande aplicação de Si3N4 foi em ferramentas abrasivas e de corte. Trituração, moagem e perfuração de metais constituem o maior custo de fabricação. Um estudo no início de 1970 estimou que havia 2 692 000 ferramentas de metal de corte de ferro nos Estados Unidos, com um custo operacional anual de US $ 64 bilhões.[18]
Granel de nitreto de silício monolítico é usado como um material para ferramentas de corte, devido à sua dureza, estabilidade térmica e resistência ao desgaste. É especialmente recomendado para a usinagem de alta velocidade de ferro fundido. Dureza, tenacidade à fratura e resistência ao choque térmico significa que nitreto de silício pode cortar ferro fundido, aço duro e ligas de níquel com base, com velocidades de superfície até 25 vezes mais rápido do que aqueles obtidos com os materiais convencionais, como carboneto de tungstênio. O uso de Si3N4 em ferramentas de corte tem tido um efeito dramático sobre a produção industrial. Por exemplo, faceamento de ferro fundido cinzento com inserções de nitreto de silício duplicou a velocidade de corte, o aumento da vida útil da ferramenta de uma parte para seis peças por aresta, e reduziu o custo médio de inserções de 50%, em comparação com ferramentas de carboneto de tungstênio tradicional.[3][18]
Eletrônicos[editar | editar código-fonte]
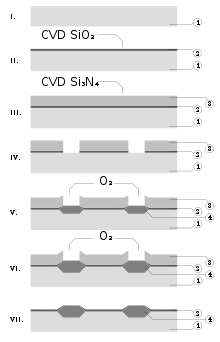
O nitreto de silício é freqüentemente utilizado como um isolante e barreira química na fabricação de circuitos integrados, para isolar eletricamente diferentes estruturas. Como uma camada de passivação de microchips, ele é superior ao dióxido de silício, como é uma barreira de difusão significativamente melhor contra as moléculas de água e íons de sódio, duas fontes principais de corrosão e instabilidade em microeletrônica. Ele também é usado como um dielétrico entre as camadas de polisilício em capacitores em chips analógicos.[22]

O nitreto de silício depositado por LPCVD contém até 8% de hidrogênio. Ele também possui grande resistência a tração, que pode rachar filmes com espessuras superiores a 200 nm. No entanto, tem maior resistência dielétrica e resistividade do que a maioria dos isolantes comumente disponíveis em microfabricação (1016 Ω • cm e 10 MV / cm, respectivamente).[7]
Não apenas o nitreto de silício, mas também compostos ternários vários de nitrogênio, silício e hidrogênio (SiNxHy) são usadas camadas isolantes. Eles são depositados por plasma utilizando as seguintes reações:[7]
- 2 SiH4(g) + N2(g) → 2 SiNH(s) + 3 H2(g)
- SiH4(g) + NH3(g) → SiNH(s) + 3 H2(g)
esses filmes de SiNxHy têm muito menos estresse de tração, mas pior propriedades elétricas (resistividade 106-1015 Ω/ cm, e rigidez dielétrica 1-5 MV/ cm).[7][23]
O nitreto de silício também é usado no processo xerográfico como uma das camadas do tambor foto.[24] Ele também é usado como uma fonte de ignição para aparelhos domésticos.[25] Por causa de suas boas propriedades elásticas, ele, junto com silício e óxido de silício, é o material mais popular para modilhões (sensores de microscópios de força atômica).[26]
Referências
- ↑ Refractive index database
- ↑ Deville, H. and Wohler, F. (1857). «Erstmalige Erwahnung von Si3N4». Liebigs Ann. Chem. 104: 256
- ↑ a b c d e f g h Frank L. Riley (2004). «Silicon Nitride and Related Materials». Journal of the American Ceramic Society. 83 (2): 245. doi:10.1111/j.1151-2916.2000.tb01182.x[ligação inativa]
- ↑ C. Barry Carter, M. Grant Norton (2007). Ceramic Materials: Science and Engineering. [S.l.]: Springer. p. 27. ISBN 0387462708
- ↑ M. R.Lee; et al. (1995). «Nierite (Si3N4), a new mineral from ordinary and enstatite chondrites». Meteoritics. 30: 387. Bibcode:1995Metic..30..387L
- ↑ «Nierite». Mindat. Consultado em 8 de agosto de 2009
- ↑ a b c d e Yoshio Nishi, Robert Doering (2000). Handbook of semiconductor manufacturing technology. [S.l.]: CRC Press. pp. 324–325. ISBN 0824787838
- ↑ «Comparison of vertical and horizontal tube furnaces in the semiconductor industry». Consultado em 6 de junho de 2009
- ↑ «deposition of silicon nitride layers». Consultado em 6 de junho de 2009
- ↑ Mahua Ghosh Chaudhuri; et al. (2008). «A novel method for synthesis of α-Si3N4 nanowires by sol–gel route» (PDF). Sci. Technol. Adv. Mater. 9 (1): 015002. doi:10.1088/1468-6996/9/1/015002
- ↑ a b c «Silicon Nitride – An Overview». Consultado em 6 de junho de 2009
- ↑ T. Nishimura; et al. (2007). «Fabrication of silicon nitride nanoceramics—Powder preparation and sintering: A review» (PDF). Sci. Technol. Adv. Mater. 8 (7-8): 635. doi:10.1016/j.stam.2007.08.006
- ↑ a b H. Peng (2004). «Spark Plasma Sintering of Si3N4-Based Ceramics - PhD thesis». Stockholm University. Consultado em 6 de junho de 2009
- ↑ «Crystal structures of Si3N4». Consultado em 6 de junho de 2009
- ↑ «Hardness and thermal stability of cubic silicon nitride». J. Phys.: Condens. Matter. 13: L515. 2001
- ↑ «Properties of gamma-Si3N4». Consultado em 6 de junho de 2009
- ↑ X. Zhu; et al. (2008). «Textured silicon nitride: processing and anisotropic properties - Topical review» (PDF). Sci. Technol. Adv. Mater. 9 (3): 033001. doi:10.1088/1468-6996/9/3/033001
- ↑ a b c d e «Ceramic Industry» (PDF). Oak Ridge National Laboratory. Consultado em 6 de junho de 2009. Cópia arquivada (PDF) em 2 de outubro de 2006
- ↑ «Ceramic Balls Increase Shuttle Engine Bearing Life». NASA. Consultado em 6 de junho de 2009
- ↑ «Space Shuttle Main Engine Enhancements». NASA. Consultado em 6 de junho de 2009
- ↑ «Silicon Nitride Rocket Thrusters Test Fired Successfully». NASA. Consultado em 6 de junho de 2009
- ↑ Hugh O. Pierson (1992). Handbook of chemical vapor deposition (CVD). [S.l.]: William Andrew. p. 282. ISBN 0815513003
- ↑ S.M.Sze (2008). Semiconductor devices: physics and technology. [S.l.]: Wiley-India. p. 384. ISBN 812651681X
- ↑ Schein, L.B. (1988). Electrophotography and Development Physics, Springer Series in Electrophysics. 14. [S.l.]: Springer-Verlag, Berlin
- ↑ L. M.Levinson et al. "Ignition system for a gas appliance" Patente E.U.A. 6 217 312, 17 April 2001
- ↑ M. Ohring (2002). The materials science of thin films: deposition and structure. [S.l.]: Academic Press. p. 605. ISBN 0125249756