Amónio
| Íon amônio Alerta sobre risco à saúde | |
|---|---|

| |
| |

| |
| Identificadores | |
| Número CAS | |
| PubChem | |
| SMILES |
|
| InChI | 1S/H3N/h1H3/p+1
|
| Propriedades | |
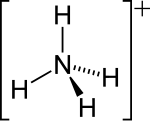
| Fórmula molecular | NH4+ |
| Acidez (pKa) | 9.25 (25 °C) [1] |
| Compostos relacionados | |
| Outros aniões/ânions | Anião amida (NH2-) |
| Outros catiões/cátions | Hidrônio (H3O+) Fosfónio (PH4-) Tetrametilamónio ((CH3)4N+) |
| Compostos relacionados | Amónia Cloreto de amônio |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
O catião amónio (português europeu) ou cátion amônio (português brasileiro) é um íon poliatómico carregado positivamente com fórmula química NH4+. Tem massa molecular 18,04 e é formado por protonação do amoníaco (NH3).
As características deste íon são semelhantes às dos íons de metais alcalinos. Por eletrólise com um cátodo de mercúrio, pode ser preparada uma amálgama de amónio que possui propriedades análogas ao amálgama de sódio ou potássio.
Os sais de amônio são geralmente compostos solúveis em água, formando soluções incolores (a menos que o ânion seja colorido). Por aquecimento todos os saís de amônio decompõem-se em amoníaco e no ácido correspondente. A menos que o ácido não seja volátil, os sais podem ser quantitativamente removidos de misturas secas por aquecimento.
As reações do ión amónio são, em geral, semelhantes às do potássio, devido ao tamanho dos íons serem quase idênticos.
Referências
- ↑ David R. Lide (2009). CRC Press Inc, ed. CRC Handbook of Chemistry and Physics (Relié) (em inglês). [S.l.: s.n.] 2804 páginas. ISBN 978-1-420-09084-0
Bibliografia[editar | editar código-fonte]
Vogel, A. I. Química Analítica Qualitativa. 5° Edição, 1981
