Fluoreto de cobre(II)
| Fluoreto de Cobre(II) Alerta sobre risco à saúde | |
|---|---|

| |
| |

| |
| |
| Nome IUPAC | Copper difluoride |
| Outros nomes | Cupric fluoride; Copper fluoride; Copper (2+) Difluoride |
| Identificadores | |
| Número CAS | |
| PubChem | |
| ChemSpider | |
| SMILES |
|
| InChI | 1/Cu.2FH/h;2*1H/q+2;;/p-2
|
| Propriedades | |
| Fórmula molecular | CuF2 |
| Massa molar | 101.543 g/mol (anhydrous) 137.573 g/mol (dihydrate) |
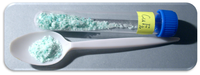
| Aparência | White crystalline powder When hydrated: Blue |
| Densidade | 4.23 g/cm3 (anhydrous) 2.934 g/cm3 (dihydrate)[1] |
| Ponto de fusão |
836 °C, 1109 K, 1537 °F |
| Ponto de ebulição |
1676 °C, 1949 K, 3049 °F |
| Solubilidade em other solvents | Hygroscopic |
| Susceptibilidade magnética | +1050.0·10−6 cm3/mol |
| Riscos associados | |
| EUA Limite de exposição permissível (PEL) |
TWA 1 mg/m3 (as Cu)[2] |
| Compostos relacionados | |
| Outros aniões/ânions | Copper(II) bromide Copper(II) chloride |
| Outros catiões/cátions | Silver(II) fluoride Cobalt(II) fluoride |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
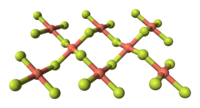
O fluoreto de cobre(II) é um composto inorgânico com a fórmula química CuF2 . É um sólido higroscópico branco ou verde, cristalino. Tem uma estrutura cristalina do tipo rutilo semelhante a outros fluoretos de fórmulas químicas MF2 .
Estrutura[editar | editar código-fonte]
O fluoreto de cobre(II) é feito de uma estrutura cristalina. Tem uma estrutura cristalina monoclínica e não pode alcançar uma estrutura de simetria superior. Forma prismas retangulares e tem base do tipo paralelogramo. Contém três vetores onde um vetor é perpendicular a dois vetores paralelos na estrutura.
Usos[editar | editar código-fonte]
Foi demonstrado que os hidrocarbonetos aromáticos reagem com o fluoreto de cobre (II), em uma atmosfera contendo oxigênio em temperaturas acima de 450 °C, para formar hidrocarbonetos aromáticos fluorados. Esta reação é mais simples que a reação de Sandmeyer , mas é aplicável apenas para compostos que são estáveis o suficiente para sobreviver à alta temperatura.[3]
Meio mol de oxigênio é usado com 2 HF e Cu para fazer um mol de água e fluoreto de cobre (II).
O fluoreto de cobre (II) também pode ser usado para formar fluorobenzeno a partir de benzeno, HCl e oxigênio. Usando um fluoreto de metal que pode oxidar com sucesso com uma ligação de metil. A reação é iniciada pela produção de fluoreto de cobre(II) com um reator de metal carregado contendo óxido de cobre e a adição de HF a altas temperaturas, a partir daí é exposto ao benzeno e fluoroaromáticos ocorrem causando a formação de fluorotolueno ou fluorobenzeno ou algum outro benzeno fluorado derivado. Isso permite que fluoroaromáticos sejam feitos em larga escala sem a eliminação de resíduos dos processos atuais de fluoração.
Química[editar | editar código-fonte]
O fluoreto de cobre(II) pode ser sintetizado a partir de cobre e flúor a temperaturas de 400 ° C. Ocorre como uma reação direta.
- Cu + F 2 → CuF 2
Perde flúor no estágio fundido a temperaturas acima de 950 ° C.
- 2CuF 2 → 2CuF + F 2
- 2CuF → CuF 2 + Cu
Os ânions complexos de CuF3 - , CuF4 2− e CuF6 4 - são formados se o CuF2 for exposto a substâncias contendo íons fluoreto F - .
Solubilidade[editar | editar código-fonte]
É levemente solúvel em água, mas começa a se decompor quando em água quente, formando íons básicos F - e Cu(OH).
- ↑ Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0-07-049439-8
- ↑ NIOSH Pocket Guide to Chemical Hazards. «#0150» (em inglês). National Institute for Occupational Safety and Health (NIOSH)
- ↑ «A "Greener" Synthetic Route for Fluoroaromatics via Copper (II) Fluoride». Science. 297. PMID 12215637. doi:10.1126/science.1076397

