Síntese de Williamson: diferenças entre revisões
m Bot: Adicionando: sl:Williamsonova sinteza etrov Modificando: de:Williamson-Ethersynthese, zh:威廉姆逊合成 |
|||
| Linha 32: | Linha 32: | ||
[[Categoria:reações químicas]] |
[[Categoria:reações químicas]] |
||
[[de:Williamson- |
[[de:Williamson-Ethersynthese]] |
||
[[en:Williamson ether synthesis]] |
[[en:Williamson ether synthesis]] |
||
[[ja:ウィリアムソン合成]] |
[[ja:ウィリアムソン合成]] |
||
[[pl:Reakcja Williamsona]] |
[[pl:Reakcja Williamsona]] |
||
[[sl:Williamsonova sinteza etrov]] |
|||
[[zh:威廉姆逊合成 |
[[zh:威廉姆逊合成]] |
||
Revisão das 18h15min de 11 de setembro de 2008
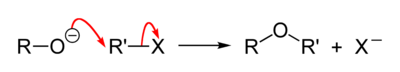
A reação de Williamson ou síntese de éteres de Williamson, foi desenvolvida por Alexander Williamson em 1850. Tipicamente ela envolve a reação de um íon alcóxido com uma haleto de alquila primário via uma reação SN2. Esta reação é importante na história da química orgânica porque ela ajuda a provar a estrutura de éteres.
O mecanismo geral da reação é a seguinte:
Um exemplo é a reação de etóxido de sódio com cloroetano para formar éter dietílico e cloreto de sódio:
- Na+C2H5O− + C2H5Cl → C2H5OC2H5 + Na+Cl−
Escopo
A reação de Williamson é de uma amplo escopo, é largamente usada tanto em sínteses em laboratório quanto na indústria, e lembra o mais simples e popular método de preparação de éter. Tanto éteres simétricos e assimétricos são facilmente preparados, e reações intramoleculares podem também ser conduzidas. No caso de éteres assimétricos há duas possibilidades para a troca de reagentes, e uma é normalmente preferível com base na disponibilidade ou na reatividade. A reação de Williamson é também frequentemente usada para preparar um éter indiretamente de dois álcoois. Um dos álcoois é primeiro convertido a um grupo lábil (usualmente tosilato), então os dois são reagidos juntos.
O alcóxido (ou aróxido) pode ser primário, secundário ou terciário. O agente alquilante, por outro lado é preferivelmente primário. Agentes de alquilação secundários também reagem, mas terciários são normalmente demasiados propensos a reações laterais para serem de uso prático. O grupo lábil é mais frequentemente um haleto ou um éster sulfonato sintetizado para o propósito da reação. Desde que as condições da reação são previamente determinadas, grupos protetores são frequentemente usadas para pacivar outra partes das moléculas reactantes (e.g. outros álcoois, aminas, prótons ácidos, etc.)
Procedimentos
Referências
- (1850) "Theory of Aetherification". Philosophical Magazine 37: 350-356.
Ligações externas
- Williamson Synthesis - www.organic-chemistry.org (em inglês)
- Williamson ether synthesis - www.chemhelper.com (em inglês)