Álcool
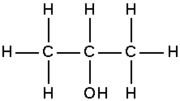
Álcool (do árabe al-kohul) (do árabe al-khwl الكحول, ou al-ghawl الغول, ‘o espírito’, ‘toda substância pulverizada’, ‘líquido destilado’) quase sempre se refere ao etanol, e por extensão a qualquer bebida que contenha etanol (bebida alcoólica). Em química, álcool é um termo mais geral, aplicado a qualquer composto orgânico em que um dos carbonos está ligado a um grupo hidroxila (-OH) substituindo um átomo de hidrogénio. A fórmula geral é CnH2n+1OH. Além disso, esse carbono deve ser saturado, ou seja, deve ter apenas ligações simples com cada átomo;[2] isso difere de álcoois dos fenóis.[3] Entre esses compostos, temos como exemplo o etanol, comumente utilizado como combustível, esterilizante e solvente. É o componente principal das bebidas alcoólicas.
Se contiverem vários grupos hidroxila, são chamados de poliálcoois. Os poliálcoois são substâncias cuja estrutura consiste numa cadeia de carbono com um grupo OH em cada um dos carbonos. Os poliálcoois de interesse alimentar mais importantes são aqueles obtidos pela redução do grupo aldeído ou cetona de um monossacarídeo, ou pela redução do grupo carbonila livre, se houver, de um oligossacarídeo. Esta redução é realizada em escala industrial com hidrogénio na presença de níquel como catalisador. No caso daqueles obtidos a partir de dissacarídeoss, os poliálcoois também possuem o anel fechado de um dos monossacarídeos, mas com o grupo carbonila em forma não redutora.
Dependendo do número de átomos de hidrogénio substituídos no átomo de carbono ao qual o grupo hidroxila está ligado, os álcoois podem ser ""primários"" (R–CH2-OH, onde R pode ser um carbono grupo alquil ou, no caso de metanol, outro H[4]) (grupo hidróxido localizado num carbono que por sua vez está ligado a um único carbono), secundário' (R2–CH-OH, onde R é um alquil grupo) (grupo hidróxido localizado num carbono que por sua vez está ligado a dois carbonos) ou terciário' (R3–C-OH, onde R indica um grupo alquil) ( grupo hidróxido localizado num carbono que por sua vez está ligado a três carbonos).[5][6][7]
Os álcoois formam uma ampla classe de compostos diversos: são muito comuns na natureza e frequentemente desempenham funções importantes nos organismos. Álcoois são compostos que podem desempenhar um papel importante na síntese orgânica, possuindo uma série de propriedades químicas únicas. Na sociedade humana, os álcoois são produtos comerciais com inúmeras aplicações, tanto na indústria como nas atividades quotidianas; o etanol, um álcool, contém-o em inúmeras bebidas.[8]
Tipos[editar | editar código-fonte]
- O etanol, conhecido como álcool etílico, é o tipo de álcool mais comum. Está contido nas bebidas alcoólicas, que é formado pela fermentação anaeróbica (sem ar) do açúcar, é usado para limpeza doméstica, fabricação de formaldeído, aditivo de gasolina e também é combustível para automóveis. A fórmula do álcool etílico é CH3CH2OH e seu ponto de ebulição 78,50C.
- O metanol (álcool metílico) não deve ser ingerido e nem inalado, pois é extremamente tóxico para o fígado e outras regiões do corpo. Uma pequena quantidade de 30 mL desse álcool no organismo leva à morte. Uma quantidade de 15 mL causa cegueira. O metanol é também usado como solvente, como anticongelante na gasolina e como combustível em carros de alta potência. É frequentemente chamado de "álcool da madeira", porque era produzido originalmente pelo aquecimento da madeira na ausência de ar. A fórmula do metanol é (CH3OH) e seu ponto de ebulição 65,00C.
- Os dois exemplos acima são casos particulares de álcoois do tipo, (R-OH, em que R-) é um radical alquila.
- Álcool anidro é um álcool com até 1% de água (já que é difícil a obtenção de álcool totalmente puro), e pode ser adicionado à gasolina para aumento da octanagem, atuando como antidetonante, para que a gasolina possa ser comprimida no pistão do motor carburante ao máximo e não entre em combustão antes de acionada a vela do motor.
- O álcool bornílico é obtido ligado com o hidroterpendio que corresponde a cânfora.
- O propanol (álcool propílico) é um solvente industrial de fórmula CH3CH2CH2OH e seu ponto de ebulição 97,40C.
- O propan-2-ol (álcool isopropílico) é um álcool medicinal de fórmula CH3CH(OH)CH3 e seu ponto de ebulição 82,40C (nos Estados Unidos, este álcool é comumente utilizado em hospitais e pelos consumidores para desinfecção, ao contrário do Brasil, onde se usa o álcool etílico).
- O etano-1,2-diol (etilenoglicol) é um anticongelante de fórmula HOCH2CH2OH e seu ponto de ebulição 1980C.
- O propano-1,2,3-triol conhecido como glicerol (glicerina) é umidificante/umectante em produtos de consumo e seu ponto de ebulição 2900C.
Classificação[editar | editar código-fonte]
Álcoois primários[editar | editar código-fonte]
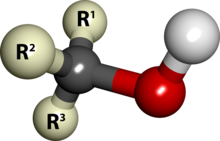
Os álcoois primários têm o grupo hidroxila ou oxidrila ligado a um carbono primário, como por exemplo o etanol. Sua fórmula geral é:
![]() (Na figura, "R" representa um radical hidrocarboneto qualquer).[9]
(Na figura, "R" representa um radical hidrocarboneto qualquer).[9]
Álcoois secundários[editar | editar código-fonte]
A fórmula geral dos álcoois secundários é:
onde "R" representa um radical hidrocarboneto qualquer.[9]
Os álcoois secundários têm o grupo hidroxila ligado a um carbono secundário (isto é, um átomo de carbono que está ligado a apenas dois outros átomos de carbono), como é o caso do 2-propanol:
Álcoois terciários[editar | editar código-fonte]
Os álcoois terciários têm o grupo hidroxila ligado a um carbono terciário. Como o 2-metil-2-propanol e o trimetilcarbinol. A fórmula geral é representada com "R", representa um radical hidáocarboneto qualquer.
Nomenclatura[editar | editar código-fonte]
A nomenclatura da IUPAC utiliza o prefixo relativo ao número de carbonos da cadeia principal, que deve incluir o grupo OH, que é indicado pelo sufixo -ol. Em álcoois de três carbonos a posição do grupo hidroxila é indicada na cadeia, colocando o número no início do nome ou antes do sufixo -ol. Se a cadeia for ramificada, é necessário indicar a posição dos radicais, mantendo o menor número possível para o grupo OH e a presença de dois grupos -OH é indicada pela numeração e pelo prefixo di, três grupos OH pelo prefix tri, e assim por diante. Veja os exemplos:

Produção[editar | editar código-fonte]

O etanol pode ser produzido por fermentação de biomassa ou a partir de hidratação do eteno. A via fermentativa usa matérias primas de origem vegetal que possuem altos índices de frutose. A principal matéria prima utilizada é a cana-de-açúcar, mas podem também ser usadas outras matérias como o milho, a mandioca e o eucalipto. Após o corte, é feito o transporte da matéria para a usina, onde ocorre a lavagem e a moagem seguida da filtragem, de onde são obtidos a garapa e o bagaço. A garapa é aquecida, formando um líquido viscoso e rico em açúcar, o melaço.
Depois, adiciona-se ao melaço um pouco de água e ácido, de onde obtemos o mosto. Após 50 horas de fermentação 13% do mosto torna-se álcool e é enviado para a destilação.[10]
Para obter o álcool etílico a partir da mistura é feita uma destilação fracionada. Para o álcool puro ou anidro, retira-se a água excedente. O processo consiste na adição de cal vivo à mistura que ao entrar em reação com a água forma o hidróxido de cálcio que não é solúvel em álcool, assim formando uma mistura heterogênea que é separada.[11] O álcool produzido é quantificado através de medidores de vazão ou tanques calibrados e depois enviados para o armazenamento, onde aguardam a posterior remoção por meio de caminhões para a comercialização. Cada litro de álcool obtido na destilação produz cerca de 12 litros de resíduos que recebem o nome de vinhaça e são aproveitados como fertilizante no próprio canavial.[10]
A reação de hidratação do eteno (H2C=CH2) ocorre em meio ácido, na presença de quantidade estequiométrica de água, resultando em etanol. Enquanto o etanol obtido por fermentação apresenta 5 % de água, resultado da formação de azeótropo, o etanol formado pela via química não apresenta água.
Gel[editar | editar código-fonte]
Para fins de higienização de ambientes e do corpo humano, é fabricado o álcool na versão pastosa (álcool em gel), ou seja, contendo aditivos que conferem a forma de gel. As vendas do álcool em gel no Brasil aumentaram muito em 2009, quando do auge da epidemia da Gripe A, e em 2020, com a epidemia da Covid-19. Possui entre 60% e 80% de etanol, concentração mais adequada para ação como desinfetante, e é menos inflamável que o álcool etílico vendido de forma convencional. É a principal forma de gel desinfetante.
No Brasil, além da confusão entre os termos "alcool" e "etanol", há uma grande confusão devido à falta de rigor na padronização das unidades. São distintas as concentrações de álcool em:
Exceto pelo fato de o grau GL ser mais preciso e uma unidade química padronizada, em geral "%" e "GL" serão sinônimos, ou seja, interpreta-se o "%" como "percentual volumétrico em solução aquosa". Por exemplo um frasco de álcool com 90° GL tem 90% em volume de álcool, e 10% em volume de água.Quantidade: 70% 70° GL 70° INPM Informa: Concentração de álcool em relação a não-álcool. Grau Gay-Lussac, volume em solução aquosa. Grau INPM, massa em solução aquosa.
Já as unidades GL e INPM medem a razão entre grandezas diferentes, massa e volume.[12] O álcool etílico possui densidade igual a 0,789 g/cm³, isso significa que a massa de álcool presente numa solução 70 °INPM é maior que aquela massa presente numa solução 70 °GL. Elas somente seriam iguais se a densidade fosse igual a 1 (um). Na prática podemos usar a aproximação 70 °GL ~ 65° INPM, e 77°GL ~ 70° INPM.[13]
Durante a Pandemia de COVID-19 também houve muito confusão quanto ao produto mais efetivo na higienização. A OMS e a OPAS recomendam:
- (...) nas formulações em gel, espuma e outras, a concentração mínima do álcool deve ser de 70%, com atividade bacteriana comprovada por testes de laboratório específicos.[14]
Algumas variantes padronizadas são utilizadas para ação germicida, como a solução de álcool etílico a 77°GL com 5% de clorexidina.[13]
Propriedades físicas de álcoois[editar | editar código-fonte]
Os álcoois apresentam ponto de fusão e ebulição bem mais altos do que os hidrocarbonetos de massa molar semelhante. Por exemplo, o ponto de ebulição do etanol é 78 C, enquanto o p.eb. do propano é de -42 C. A diferença de propriedades físicas é o resultado das ligações de hidrogênio (pontes de hidrogênio) intermoleculares, que aproximam as moléculas e resultam em fortes interações.
| Álcool | ponto de fusão (C) | Ponto de ebulição (C) |
|---|---|---|
| metanol | -97 | 65 |
| etanol | -114 | 78 |
| 1-propanol | -126 | 97 |
| 2-propanol | -89 | 83 |
| 1-butanol | -114 | 118 |
| 2-butanol
(sec-butanol) |
-108 | 100 |
| 2-metil-1-propanol
(isobutanol) |
-108 | 108 |
| 2-metil-2-propanol
(terc-butanol) |
25 | 83 |
Os álcoois de cadeia curta (até 3 carbonos ) são totalmente solúveis em água e conforme aumenta a cadeia, a solubilidade em água diminui, pelo aumento da parte hidrofóbica da molécula.
Reações de álcoois[editar | editar código-fonte]
Os álcoois são ácidos fracos, com pKa entre de 16 a 19 e reagem com bases fortes, como hidreto de sódio ou sódio e formam sais chamados alcóxidos, com a fórmula geral RO-M +.
2 R-OH + 2 NaH → 2 R-O-Na + + H2
2 R-OH + 2 Na → 2 R-O-Na + + H2
A acidez dos álcoois é fortemente afetada pela solvatação. Na fase gasosa, os álcoois são mais ácidos do que na água. O grupo OH não é um bom grupo de saída em reações de substituição nucleofílica, portanto os álcoois neutros não reagem nessas reações. Para a ativação da hidroxila, existem diversos métodos disponíveis. O primeiro é a adição de ácido forte para protonar o oxigênio e resultar no R-OH2+, em que o grupo de saída é água, muito mais estável.
Outra forma é a transformação em haletos de alquila (ou haloalcanos) correspondentes. Álcoois terciários reagem com ácido clorídrico para produzir haletos de alquila terciários, onde o grupo hidroxila é substituído por um átomo de cloro através do mecanismo de substituição nucleofílica unimolecular, enquanto álcoois secundários reagem lentamente e álcoois primários (exceção: álcool benzílico) não reagem. Esta é a base do Teste de Lucas, usado para distinguir álcoois terciários, secundários e terciários. Para a reação de álcoois primários, pode ser utilizado o usando cloreto de tionila.[15] Os álcoois podem ser convertidos em ésteres sulfônicos usando cloreto de tosila (cloreto de p-toluenosulfonila) e depois reagir com outros nucleófilos.
Álcool e ácidos carboxílicos reagem na chamada esterificação de Fischer. A reação geralmente requer um catalisador, como ácido sulfúrico concentrado:
R-OH + R'-CO2H → R'-CO2R + H2O
Os álcoois primários (R-CH2OH) podem ser oxidados em aldeídos (R-CHO) ou em ácidos carboxílicos (R-CO2H). A oxidação de álcoois secundários (R1R2CH-OH) normalmente termina no estágio de cetona (R1R2C = O). Os álcoois terciários (R1R2R3C-OH) são resistentes à oxidação. A oxidação direta de álcoois primários em ácidos carboxílicos ocorre normalmente através do aldeído correspondente, que é transformado através de um hidrato de aldeído (R-CH (OH) 2) por reação com água antes que possa ser oxidado ainda mais ao ácido carboxílico.
Consumo pelo ser humano[editar | editar código-fonte]

Percepção Inicial[editar | editar código-fonte]
O álcool é uma droga depressora do sistema nervoso central que causa desinibição e euforia quando ingerido na forma de bebidas alcoólicas pelos seres humanos. Em doses mais altas, o álcool é prejudicial a saúde, podendo causar estupor e até coma.[16]
Influência dos Neurotransmissores[editar | editar código-fonte]
O etanol aumenta os efeitos do Gaba, um neurotransmissor inibitório, o que causa os movimentos lentos e a fala enrolada que frequentemente se observam em pessoas alcoolizadas. Ao mesmo tempo, inibe o neurotransmissor excitatório glutamato, suprimindo seus efeitos estimulantes e levando a um tipo de retardamento fisiológico. O sistema Gaba atua sobre o controle da ansiedade. Ou seja, quando "armado" pela inibição da produção de glutamato, deixa as pessoas mais relaxadas e com capacidade de interagir melhor com grupos. Quanto mais Gaba, menos autocontrole.[17] A ingestão de álcool está fortemente associada a manifestação de violência, comportamentos impulsivos e agressivos. Afinal a impulsividade é controlada pelo sistema Gaba e o álcool é um modulador alostérico positivo do receptor GABA-A.[18] Assim, o álcool pode aumentar a impulsividade e reduzir o controle das funções executivas, isto é o controle top-down, sobre os comportamentos sociais.[19]
Além disso, o álcool também aumenta a liberação de serotonina, neurotransmissor que serve para regular o prazer e o humor. Com mais serotonina, que é considerado o hormônio a felicidade, mais euforia - e, em alguns casos, atitudes que podem resultar em atos violentos tal como acontece com o Gaba. Existe, também, o efeito do neurotransmissor glutamato. No caso, em uma situação em que o álcool é constantemente ingerido, ocorre um aumento dos receptores glutamatérgicos. Diante disso, quando se interrompe esse consumo, a pessoa começa a sofrer síndrome de abstinência, ficando hiperativa, podendo desencadear crises convulsivas, até mesmo a sofrer acidentes vasculares cerebrais.[20][21]
Efeitos do Álcool[editar | editar código-fonte]
Os efeitos do álcool são percebidos em dois períodos: um de estímulo e outro de depressão. No primeiro período, o usuário se torna eufórico e desinibido. No segundo momento, ocorre descontrole, falta de coordenação motora e sono.[22] Para aqueles que sofrem de alcoolismo, em caso de suspensão do consumo, pode ocorrer a síndrome da abstinência, caracterizada por confusão mental, visões, ansiedade, tremores e convulsões.[16][23]
Os efeitos agudos do consumo do álcool são sentidos em órgãos como o fígado, coração, vasos sanguíneos e estômago. Segundo a OMS, o consumo de álcool quando superior a 60 gramas por semana é considerado abusivo e extremamente nocivo para a saúde. No mundo, 11,5 % dos consumidores de álcool bebem em excesso semanalmente. Estima-se que pelo menos 2,5 milhões de pessoas em todo o mundo morrem por ano por causa do consumo inadequado de álcool.[24]
Consequências[editar | editar código-fonte]
Um consumo exagerado de álcool, principalmente em um curto espaço de tempo, pode gerar falhas no sistema de registro cerebral, levando a pessoa a sofrer um blecaute alcoólico. O chamado Transtorno Amnésico Alcoólico consiste em uma perda de memória das situações que ocorreram durante esse consumo, e que no dia seguinte a pessoa não se lembrará de quase nada. Isso ocorre porque circuitos do hipocampo, área do cérebro que tem papel crucial em consolidar as memórias do nosso cotidiano, são inibidos pelo álcool. Outra grave síndrome neuropsiquiátrica associada ao consumo exacerbado do álcool é a Síndrome de Wernicke-Korsakoff.[25]
A Cirrose é uma condição médica em que o fígado deixa de funcionar corretamente devido a lesões prolongadas, caracterizadas pela substituição do tecido normal do fígado por tecido fibroso, isto é, há formação de tecidos de cicatrização no lugar de células saudáveis no fígado.
Álcool e seu Potencial de Dependência[editar | editar código-fonte]
A partir de estudos a respeito de drogadição é ponto pacífico que qualquer droga que tenha potencial de gerar dependência afeta o sistema de recompensas do cérebro, alterando, direta ou indiretamente, a sinalização do neurotransmissor dopamina na via mesolímbica (que estabelece contato entre uma região do sistema nervoso chamada mesencéfalo, derivando o termo “meso”, e uma região do sistema “límbico”, nomeado de núcleo Accumbens). Essa via está associada à atribuição do valor reforçador de qualquer estímulo, assim, se ele for classificado como reforçador, significa que há uma maior probabilidade de ser buscado outras vezes. Nesse sentido, o sistema de recompensa está associado a qualquer estímulo reforçador: seja comer, praticar esportes, socializar, entre outros. Há, todavia, um aspecto do sistema de recompensa em que as drogas, inclusive o álcool, possuem especial capacidade de alterar: aquilo que é chamado de “saliência” de um estímulo. A saliência de um estímulo aponta o quanto esse estímulo é novo, inusitado e potencialmente mais reforçador. A saliência está diretamente relacionada ao aumento da sinalização dopaminérgica da via mesolímbica, implicando um aumento de dopamina no núcleo Accumbens.[23][26]
Para uma explicação mais pormenorizada, veja o artigo publicado: The neuroscience of drug reward and addiction. Physiological reviews, 99(4), 2115-2140.[18]
Álcool no Cérebro em Desenvolvimento[editar | editar código-fonte]
Beber durante a gravidez pode implicar uma ampla gama de agravos ao cérebro em desenvolvimento. Isso pois, a substância entra na corrente sanguínea do adulto e acaba chegando ao útero, o que interfere na oxigenação e nutrição do feto.
Dentre os efeitos mais graves que podem ocorrer, existe um apanhado de sintomas caracterizados como Síndrome Alcoólica Fetal (SAF). Crianças com SAF podem ter características faciais alteradas, e um cérebro com tamanho geralmente inferior do que a média de sua idade e com menor volume (microcefalia).[27] Um estudo do Centro de Dependência e Saúde Mental do Canadá estima que nasçam 119 bebês por ano com a síndrome. Já a Sociedade Brasileira de Pediatria indica que, a cada mil bebês que nascem com vida, de dois a sete apresentam sintomas. Além da Síndrome do Alcoolismo Fetal, que afeta a criança, o consumo de álcool durante a gravidez também pode provocar o aborto ou o nascimento prematuro.[23]
Plasticidade do Sistema Nervoso[editar | editar código-fonte]
A ingestão de bebidas alcoólicas por usuários precoces possui consequências drásticas uma vez que, pode-se afetar principalmente a plasticidade do sistema nervoso. A neurogênese, a criação de novas células cerebrais (neurônios), é algo que ocorre intensamente durante o período de gestação e os primeiros meses de vida do ser humano. Com o tempo, esse processo reduz drasticamente, mas nunca cessa, principalmente quando se trata da adolescência onde ainda há processos cerebrais em desenvolvimento. A neurogênese está implicada, por exemplo, no processo de criação e consolidação de novas memórias. Nesse sentido, há diversos estudos que apontam que altas doses de álcool podem levar à interrupção da criação de novos neurônios. Acredita-se, ainda, que é esse processo separatório de lesões em áreas intimamente ligadas a funções cognitivas importantes, como a memória. Não obstante, um dos sintomas mais comuns ao ingerir bebidas alcoólicas é a amnésia no dia seguinte.[28] Ou seja, diversas áreas cognitivas podem ter seu desenvolvimento afetado.[29]
Álcool Combustível[editar | editar código-fonte]
Impacto Ambiental[editar | editar código-fonte]
Atualmente, há correntes que questionam o impacto ambiental do álcool combustível, pelos severos danos do desmatamento necessário para abrir espaço à monocultura de cana-de-açúcar e pelo efeito nocivo da queima da palhada, necessária para se preparar a cana para a produção de álcool. Esses danos hoje já se fazem sentir, apesar de a utilização do álcool ser ínfima se comparada aos derivados de petróleo. Contudo, a queima da palhada está decaindo com o aumento da mecanização da lavoura. Também deve-se levar em conta o fato de que o efeito da queima é minimizado pela absorção de CO2 através da fotossíntese realizada pela própria cana-de-açúcar.[30]
Ver também[editar | editar código-fonte]
Referências
- ↑ «alcohols». IUPAC Gold Book. Consultado em 29 de janeiro de 2020
- ↑ União Internacional de Química Pura e Aplicada. Compendium of Chemical Terminology. [S.l.: s.n.] (em inglês)
- ↑ IUPAC Gold Book
- ↑ CHEBI álcool primário
- ↑ Química - Textos livres - / 10.1_Structure_and_Classification_of_Alcohols Estrutura e classificação de álcoois
- ↑ «Uma introdução aos álcoois». Consultado em 22 de novembro de 2007
- ↑ Albert S. Tarendash (2001). Vamos revisar: química, o ambiente físico. Boston, Mass: Barron's. p. / 161 161. ISBN 0-7641-1664-9 zero width space character character in
|page=at position 66 (ajuda) - ↑ «Efectos del consumo de alcohol etílico en la cavidad oral: Relação com o câncer oral». Medicina y Patología Oral (PDF). 9. [S.l.: s.n.] 2004. p. 14. ISSN 1137-2834 Parâmetro desconhecido
|apelidos1=ignorado (ajuda); Parâmetro desconhecido|apelidos2=ignorado (ajuda); Parâmetro desconhecido|apelidos3=ignorado (ajuda); Parâmetro desconhecido|apelidos4=ignorado (ajuda); Parâmetro desconhecido|apelidos5=ignorado (ajuda);|nome1=sem|sobrenome1=em Authors list (ajuda);|nome2=sem|sobrenome2=em Authors list (ajuda);|nome3=sem|sobrenome3=em Authors list (ajuda);|nome4=sem|sobrenome4=em Authors list (ajuda);|nome5=sem|sobrenome5=em Authors list (ajuda) - ↑ a b «Composição do Álcool». Cepa USP. Consultado em 17 de Janeiro de 2012
- ↑ a b «Produção do Álcool». Cepa USP. Consultado em 17 de Janeiro de 2012
- ↑ «Composição do Álcool». Mezochi.net. Consultado em 17 de Janeiro de 2012
- ↑ "NOTA OFICIAL (atualizada) Esclarecimentos sobre álcool gel caseiro, limpeza de eletrônicos e outros", Conselho Federal de Química. cfq.org.br/noticia registrada em 25/03/2020.
- ↑ a b "Eficácia da desinfecção com álcool 70% (p/v) de superfícies contaminadas sem limpeza prévia", http://www.scielo.br/pdf/rlae/v21n2/pt_0104-1169-rlae-21-02-0618.pdf
- ↑ "Solução alcoólica será obrigatória em Estabelecimentos de Saúde: RDC 42", OPAS. www.paho.org/bra?id=1601
- ↑ Solomons, Graham (2018). Química Orgânica. Rio de Janeiro: LTC
- ↑ a b Scheidt, Letícia; Fries, Gabriel Rodrigo; Stertz, Laura; Cabral, João Carlos Centurion; Kapczinski, Flávio; Almeida, Rosa Maria Martins de; Scheidt, Letícia; Fries, Gabriel Rodrigo; Stertz, Laura (1 de setembro de 2015). «Ethanol during adolescence decreased the BDNF levels in the hippocampus in adult male Wistar rats, but did not alter aggressive and anxiety-like behaviors». Trends in Psychiatry and Psychotherapy. 37 (3): 143–151. ISSN 2237-6089. doi:10.1590/2237-6089-2015-0017
- ↑ «RePORT ⟩ RePORTER». reporter.nih.gov. Consultado em 26 de abril de 2021
- ↑ a b Volkow, Nora D.; Michaelides, Michael; Baler, Ruben (1 de outubro de 2019). «The Neuroscience of Drug Reward and Addiction». Physiological Reviews (4): 2115–2140. ISSN 1522-1210. PMC 6890985
 . PMID 31507244. doi:10.1152/physrev.00014.2018. Consultado em 26 de abril de 2021
. PMID 31507244. doi:10.1152/physrev.00014.2018. Consultado em 26 de abril de 2021
- ↑ de Almeida, RM; Cabral, JC; Narvaes, R. «Behavioural, hormonal and neurobiological mechanisms of aggressive behaviour in human and nonhuman primates». Physiology & Behvaior. doi:10.1016/j.physbeh.2015.02.053
- ↑ Zaleski, Marcos; Morato, Gina Struffaldi; Silva, Vilma Aparecida da; Lemos, Tadeu (maio de 2004). «Aspectos neurofarmacológicos do uso crônico e da Síndrome de Abstinência do Alcool». Brazilian Journal of Psychiatry: 40–42. ISSN 1516-4446. doi:10.1590/S1516-44462004000500010. Consultado em 26 de abril de 2021
- ↑ CISA. «Álcool e Sistema Nervoso Central». cisa.org.br. Consultado em 26 de abril de 2021
- ↑ «O Álcool». Brasil Escola. Consultado em 17 de Janeiro de 2012
- ↑ a b c CISA. «Efeitos danosos do álcool no cérebro». cisa.org.br. Consultado em 26 de abril de 2021
- ↑ «Aumenta consumo de álcool no Brasil, segundo a OMS». Portal Vermelho. Consultado em 17 de Janeiro de 2012
- ↑ Zubaran, Carlos; Fernandes, Jefferson; Martins, Fernanda; Souza, Janete; Machado, Rita; Cadore, Maria (dezembro de 1996). «Aspectos clínicos e neuropatológicos da síndrome de Wernicke-Korsakoff». Revista de Saúde Pública (6): 602–608. ISSN 0034-8910. doi:10.1590/S0034-89101996000600015. Consultado em 26 de abril de 2021
- ↑ Costa, Rita Mara Reis (2003). «O álcool e seus efeitos no sistema nervoso». Consultado em 26 de abril de 2021
- ↑ «A síndrome causada nos filhos por grávidas que consomem álcool». BBC News Brasil. Consultado em 26 de abril de 2021
- ↑ «O que é o blecaute alcoólico e por que é tão perigoso». BBC News Brasil. Consultado em 26 de abril de 2021
- ↑ Haes, Tissiana Marques; Clé, Diego V.; Nunes, Tiago F.; Roriz-Filho, Jarbas S.; Moriguti, Julio C. (30 de junho de 2010). «Álcool e sistema nervoso central». Medicina (Ribeirão Preto) (2): 153–163. ISSN 2176-7262. doi:10.11606/issn.2176-7262.v43i2p153-163. Consultado em 26 de abril de 2021
- ↑ «Combustível é renovável, mas há dúvidas sobre impacto ambiental». UOL Notícias. Consultado em 17 de Janeiro de 2012