Cryptococcus neoformans: diferenças entre revisões
Etiquetas: Edição via dispositivo móvel Edição feita através do sítio móvel |
m Foram revertidas as edições de 201.78.241.103 para a última revisão de 179.108.130.86, de 21h55min de 22 de janeiro de 2019 (UTC) Etiqueta: Reversão |
||
| Linha 20: | Linha 20: | ||
==Classificação== |
==Classificação== |
||
| ⚫ | ''Cryptococcus neoformans'' inclui duas variedades (v.): ''C. neoformans v. neoformans'' e ''v. grubii''. Uma terceira variedade, ''C. neoformans v. gattii'', é agora considerada uma espécie distinta, ''[[Cryptococcus gattii]]''. ''C. neoformans v. grubii'' e ''v. neoformans'' têm distribuição mundial e são frequentemente encontrados em solo contaminado com excremento de aves. O [[genoma]] de ''C. neoformans v. neoformans'' foi sequenciado e publicado em 2005.<ref>{{citar periódico|autor =Loftus BJ, et al. |título=The genome of the basidiomycetous yeast and human pathogen Cryptococcus neoformans |periódico=Science | volume=307 |número=5713 |páginas=1321–24 | pmid=15653466 | doi=10.1126/science.1103773 |ano=2005 }}</ref> Estudos recentes sugerem que as colónias de ''Cryptococcus neoformans'' e fungos relacionados que se desenvolvem nas ruínas do reactor [[Derretimento nuclear|derretido]] da [[Usina Nuclear de Chernobyl|Central Nuclear de Chernobyl]] podem ser capazes de utilizar a energia de [[Radiação corpuscular|radiação]] ([[radiação beta]] primária) para crescimento [[Fungo radiotrófico|radiotrófico]].<ref>{{citar periódico|autor =Dadachova E, ''et al.'' |título=Ionizing Radiation Changes the Electronic Properties of Melanin and Enhances the Growth of Melanized Fungi |periódico=PLoS One | volume=2(5)| doi=10.1371/journal.pone.0000457 | pmid=17520016 |ano=2007 |páginas=e457 |número=5 | pmc=1866175}}</ref> |
||
''Cryptococcus neoformans'' inclui duas variedades (v.): ''C. neoformans v. neoformans'' e ''v. grubii''. Uma terceira variedade, ''C. neoformans v.:------ 0 |
|||
| ⚫ | |||
==Características== |
==Características== |
||
Revisão das 15h58min de 11 de março de 2019
| Cryptococcus neoformans | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Classificação científica | |||||||||||||||
| |||||||||||||||
| Nome binomial | |||||||||||||||
| Cryptococcus neoformans (San Felice) Vuill. | |||||||||||||||
| Sinónimos | |||||||||||||||
| |||||||||||||||
Cryptococcus neoformans é uma levedura encapsulada que pode viver tanto em plantas como em animais. O seu teleomorfo é Filobasidiella neoformans, um fungo filamentoso da classe Tremellomycetes.
Classificação
Cryptococcus neoformans inclui duas variedades (v.): C. neoformans v. neoformans e v. grubii. Uma terceira variedade, C. neoformans v. gattii, é agora considerada uma espécie distinta, Cryptococcus gattii. C. neoformans v. grubii e v. neoformans têm distribuição mundial e são frequentemente encontrados em solo contaminado com excremento de aves. O genoma de C. neoformans v. neoformans foi sequenciado e publicado em 2005.[1] Estudos recentes sugerem que as colónias de Cryptococcus neoformans e fungos relacionados que se desenvolvem nas ruínas do reactor derretido da Central Nuclear de Chernobyl podem ser capazes de utilizar a energia de radiação (radiação beta primária) para crescimento radiotrófico.[2]
Características
Cryptococcus neoformans cresce geralmente na forma de levedura (unicelular) e reproduz-se por gemulação[3]. Sob certas condições, tanto na natureza como no laboratório, C. neoformans pode desenvolver-se como um fungo filamentoso.[carece de fontes] Quando cultivado como levedura, C. neoformans possui uma cápsula proeminente composta sobretudo por polissacarídeos. Microscopicamente, é utilizada tinta da China para mais fácil visualização da cápsula[4]. As partículas do pigmento da tinta não entram na cápsula que rodeia a célula esférica da levedura, resultando um "halo" em redor das células. Tal permite a identificação facil e rápida de C. neoformans.
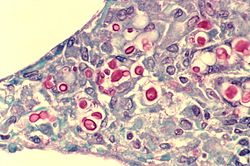
Patologia
A infecção por C. neoformans é designada criptococose[5]. A maioria das infecções por C. neoformans ocorrem nos pulmões.[carece de fontes] Contudo, a meniginte fúngica, especialmente como infecção secundária em pacientes com SIDA, é frequentemente causada por C. neoformans tornando-o um fungo particularmente perigoso[6]. As infecções causadas por este fungo são raras em pessoas com sistemas imunitários totalmente funcionais[7].[carece de fontes] Por esta razão, C. neoformans é por vezes descrito como um fungo oportunista.
Tratamento
A criptococose que não afecta o sistema nervoso central pode ser tratada exclusivamente com fluconazol.
A meningite criptocócica deve ser tratada durante duas semanas com anfotericina B intravenosa( 0.7–1.0 (mg/kg)/dia) e flucitosina oral 100 (mg/kg)/dia (ou flucitosina intravenosa 75 (mg/kg)/dia se o paciente não puder engolir). Este tratamento deve ser seguido da administração oral de 200 mg de fluconazol diariamente durante dez semanas[8] e depois 200 mg diariamente até a contagem de CD4 do paciente ser superior a 100 durante três meses e, se infectado, se a sua carga viral for indetectável.[9][10]
Ambisome intravenoso (4 (mg/kg)/dia) pode ser usado mas não se revela superior: o seu uso está reservado para pacientes que não toleram a anfotericina B. A dose de 200 (mg/kg)/dia de flucitosina não é mais eficaz, e está associada com maiores efeitos secundários, não devendo ser usada.
Na África, é usado fluconazol via oral a 200 mg/dia. Contudo, tal não resulta na cura do paciente, porque apenas suprime o fungo, não o matando; fungos viáveis podem ser cultivados a partir do líquido cefalorraquidiano de pacientes que tomaram fluconazol durante muitos meses. Um aumento da dose para 400 mg/dia não melhora o resultado,[11] mas dados preliminares do Uganda mostram que doses muito elevadas da ordem dos 1200 mg ou mais diariamente podem ser eficazes. A duração deste tratamento e a dose de manutenção pós-tratamento não é conhecida.
Referências
- ↑ Loftus BJ; et al. (2005). «The genome of the basidiomycetous yeast and human pathogen Cryptococcus neoformans». Science. 307 (5713): 1321–24. PMID 15653466. doi:10.1126/science.1103773
- ↑ Dadachova E; et al. (2007). «Ionizing Radiation Changes the Electronic Properties of Melanin and Enhances the Growth of Melanized Fungi». PLoS One. 2(5) (5): e457. PMC 1866175
 . PMID 17520016. doi:10.1371/journal.pone.0000457
. PMID 17520016. doi:10.1371/journal.pone.0000457
- ↑ Silva-Vergara, Mario León; Santos Lazéra, MáRcia Dos; Trilles, Luciana; Leite Maffei, Claudia Maria; Rodrigues, Virmondes; Pedrosa, André Luiz; Mora, Delio José (1 de junho de 2010). «Genotype and mating type distribution within clinical Cryptococcus neoformans and Cryptococcus gattii isolates from patients with cryptococcal meningitis in Uberaba, Minas Gerais, Brazil». Medical Mycology (em inglês). 48 (4): 561–569. ISSN 1369-3786. doi:10.3109/13693780903358317
- ↑ Mora, Delio José; Fortunato, Laila Rigolin; Andrade-Silva, Leonardo Eurípedes; Ferreira-Paim, Kennio; Rocha, Ivonete Helena; Vasconcelos, Rakel Rocha; Silva-Teixeira, David Nascimento; Nascentes, Gabriel Antonio Nogueira; Silva-Vergara, Mario León (23 de março de 2015). «Cytokine Profiles at Admission Can Be Related to Outcome in AIDS Patients with Cryptococcal Meningitis». PLOS ONE. 10 (3): e0120297. ISSN 1932-6203. doi:10.1371/journal.pone.0120297
- ↑ Leão, Carlos Alberto; Ferreira-Paim, Kennio; Andrade-Silva, Leonardo; Mora, Delio Jose; da Silva, Paulo Roberto; Machado, Anna Silva; Das Neves, Priscila Freitas; Pena, Giovana Silva; de Almeida Teixeira, Luciana Silva (maio de 2011). «Primary cutaneous cryptococcosis caused byCryptococcus gattiiin an immunocompetent host». Medical Mycology. 49 (4): 352–355. ISSN 1369-3786. doi:10.3109/13693786.2010.530697
- ↑ Mora, Delio José; da Cunha Colombo, Eduardo Rodrigues; Ferreira-Paim, Kennio; Andrade-Silva, Leonardo Eurípedes; Nascentes, Gabriel Antonio Nogueira; Silva-Vergara, Mario León (1 de dezembro de 2011). «Clinical, Epidemiological and Outcome Features of Patients with Cryptococcosis in Uberaba, Minas Gerais, Brazil». Mycopathologia. 173 (5-6): 321–327. ISSN 0301-486X. doi:10.1007/s11046-011-9504-9
- ↑ Mora, Delio José; Ferreira-Paim, Kennio; Andrade-Silva, Leonardo Eurípedes; Bragine, Thatiane; Rocha, Ivonete Helena; Ribeiro, Barbara de Melo; Machado, Guilherme Henrique; Rodrigues Junior, Virmondes; Silva-Teixeira, David Nascimento (9 de maio de 2017). «Cytokine patterns in a prospective cohort of HIV-infected patients with cryptococcal meningitis following initiation of antifungal and antiretroviral therapy». PLOS ONE. 12 (5): e0176304. ISSN 1932-6203. doi:10.1371/journal.pone.0176304
- ↑ Saag MS, Graybill RJ, Larsen RA; et al. (2000). «Practice guidelines for the management of cryptococcal disease. Infectious Diseases Society of America». Clin Infect Dis. 30 (4): 710–8. PMID 10770733. doi:10.1086/313757
- ↑ Martínez E, García-Viejo MA, Marcos MA; et al. (2000). «Discontinuation of secondary prophylaxis for cryptococcal meningitis in HIV-infected patients responding to highly active antiretroviral therapy». AIDS. 14 (16): 2615–26. PMID 11101078. doi:10.1097/00002030-200011100-00029
- ↑ Vibhagool A, Sungkanuparph S, Mootsikapun P; et al. (2003). «Discontinuation of secondary prophylaxis for Cryptococcal meningitis in Human Immunodeficiency Virus-infected patients treated with highly active antiretroviral therapy: a prospective, multicenter, randomized study». Clin Infect Dis. 36 (10): 1329–31. PMID 12746781. doi:10.1086/374849
- ↑ CF Schaars, Meintjes GA, Morroni C; et al. (2006). «Outcome of AIDS-associated cryptococcal meningitis initially treated with 200 mg/day or 400 mg/day of fluconazole». BMC Infect Dis. 6. 118 páginas. PMC 1540428
 . PMID 16846523. doi:10.1186/1471-2334-6-118
. PMID 16846523. doi:10.1186/1471-2334-6-118
- Este artigo foi inicialmente traduzido, total ou parcialmente, do artigo da Wikipédia em inglês cujo título é «Cryptococcus neoformans», especificamente desta versão.
Ligações externas
- «A good overview of Cryptococcus neoformans biology from the Science Creative Quarterly» (em inglês)
- «Cryptococcus neoformans biology, general information, life cycle image at MetaPathogen» (em inglês)
- «The outcome of Cryptococcus neoformans intracellular pathogenesis in human monocytes» (em inglês)


