Exoeletrógeno
O termo exoeletrógeno normalmente se refere a um micro-organismo que tem a capacidade de transferir elétrons extracelularmente. Embora exoeletrogênio seja o nome mais comum, outras denominações têm sido usadas: bactérias eletroquimicamente ativas, bactérias respiradoras de ânodo e eletrogênios.[1] Elétrons exocitados dessa maneira são obtidos após a produção de ATP por meio de uma cadeia de transporte de elétrons (ou ETC, do termo em inglês Electron transport chain) durante a fosforilação oxidativa . A respiração celular convencional requer um aceptor final de elétrons para recebê-los. As células que usam oxigênio molecular (O2) como seu aceptor final de elétrons realizam respiração aeróbica, enquanto as células que usam outros compostos solúveis como seu aceptor final de elétrons realizam respiração anaeróbica.[2] Diferentemente, o aceptor de elétrons final de um exoeletrogênio é encontrado extracelularmente e pode ser um forte agente oxidante em solução aquosa ou um condutor/aceptor de elétrons sólido. Dois aceptores comumente observados são compostos de ferro (especificamente óxido de ferro(III)) e compostos de manganês (especificamente óxido de manganês(III)).[3][4][5] Como o oxigênio é um forte oxidante, as células são capazes de fazer isso apenas na ausência de oxigênio.[6]
A utilização de exoeletrógenos está atualmente sendo pesquisada no desenvolvimento de células de combustível microbianas (ou MFCs, do termo em inglês Microbial fuel cells), que têm o potencial de converter material orgânico — como lodo ativado do tratamento de águas residuais — em etanol, gás hidrogênio e corrente elétrica.[1][7]
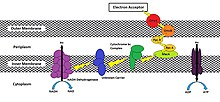
Embora o processo exato por meio qual uma célula reduz um aceptor extracelular varie de espécie para espécie, foi demonstrado que os métodos envolvem o uso de uma via de oxidorredutase que transporta elétrons para a membrana celular exposta ao ambiente externo.[3] Essa via se separa da via ETC após o complexo do citocromo bc1 (complexo III) ser oxidado por citocromos do tipo c projetados para mover os elétrons em direção à face extracelular de sua membrana mais externa em vez de em direção ao citocromo c oxidase (Complexo IV). MtrC e OmcA são exemplos de citocromos do tipo C que são encontrados endogenamente na membrana externa de Shewanella oneidensis MR-1, uma gamaproteobactéria, embora existam muitas outras variações (Figura 1).[3][4][5][7][8]
Além de liberar elétrons para um aceptor final exógeno, a transferência de elétrons externos pode ter outros fins. Em primeira análise, as células podem transferir elétrons diretamente umas para as outras sem a necessidade de uma substância intermediária. Pelotomaculum thermopropioncum foi observado ligado ao Methanothermobacter thermautotrophicus por um pilus (estruturas celulares externas usadas na conjugação e na adesão) que determinou-se ser um condutor de eletricidade. Em segunda análise, os elétrons extracelulares podem desempenhar um papel na comunicação como um sinal de quorum em biofilmes.[1]
Ainda em relação a S. oneidensis MR-1, atividade exoeletrogênica foi observada nas seguintes variantes de bactérias sem um mediador exógeno: Shewanella putrefaciens IR-1, Clostridium butyricum, Desulfuromonas acetoxidans, Geobacter metallireducens, Geobacter sulfurreducens, Rhodoferax ferrireducens, Aeromonas hydrophilia (A3), Pseudomonas aeruginosa, Desulfobulbus propionicus, Geopsychrobacter electrodiphilus, Fermentans geothrix, Shewanella oneidensis DSP10, Escherichia coli, Rhodopseudomonas palustris, Ochrobactrum anthropi YZ-1, Desulfovibrio desulfuricans, Acidiphilium sp. 3.2Sup5, Klebsiella pneumoniae L17, Thermincola sp. variante JR, Pichia anomala.[1]
Mecanismos de transporte extracelular de elétrons
[editar | editar código-fonte]
Foi demonstrado que enzimas oxidorredutase reduzidas na membrana extracelular usam os seguintes métodos na transferência de seus elétrons para o aceptor final exógeno: contato direto, transporte por meio de mediadores excretados, agentes quelantes de ferro,[9] via biofilme condutor e via pili condutores (Figura 2). No entanto, é possível que esses métodos não sejam mutuamente exclusivos[8] e o método utilizado pode depender das condições ambientais. Sob baixas densidades populacionais microbianas, o uso de lançadores de elétrons e queladores sintetizados pelo exoeletrogênio pode ser energeticamente dispendioso devido à concentração insuficiente dessas moléculas necessária para recuperação e reutilização.[9] Nessas circunstâncias, a transferência direta seria favorecida; contudo, os benefícios de energia superariam as demandas de energia quando a comunidade microbiana atingisse dimensão suficiente.
A redução direta de um aceptor exógeno é alcançada por meio do contato entre as oxidorredutases da célula e o aceptor final de elétrons (ou seja, um eletrodo ou composto de metal externo). Embora essas proteínas sejam diversas (assumindo formas solúveis ou ligadas à membrana), suas localizações comuns na membrana externa ou periplasma em bactérias Gram-negativas e Gram-positivas fornecem contato íntimo para a transferência de elétrons.[10]
Além disso, a presença de doadores de elétrons aumenta drasticamente a taxa de transferência direta.[4] A título de exemplo, em Shewanella oneidensis MR-1, o transporte é caracterizado por uma série de proteínas oxirredutoras e estruturais [11] estendidas da membrana citoplasmática até a superfície celular externa (semelhante à Figura 1). As flavinas são secretadas, o que acredita-se preencher a “lacuna” entre as proteínas da superfície celular e o metal externo, podendo-se reduzir a necessidade de contato imediato e facilitar a transferência à distância.[9] Além disso, haja vista que citocromos geralmente reconhecem superfícies específicas no metal do substrato,[10] flavinas solúveis podem atuar como uma ponte universal permitindo a doação de elétrons para uma variedade de diferentes formatos e tamanhos de metal[4], o que pode ser útil na aplicação de células a combustível microbianas. Também foi sugerido que as flavinas se ligam às proteínas terminais de transferência de elétrons como cofatores para aumentar as taxas de oxidação.[11]
No caso da Geobacter sulferreducens, a riboflavina portadora de elétrons é utilizada; todavia, o transportador de elétrons não é inteiramente solúvel e pode ser fracamente ligado ao biofilme da cultura, resultando em um biofilme altamente condutor. Além disso, G. sulferreducens produz pili (nanofios) eletricamente condutores com enzima oxidoredutase OmcS embutida em sua superfície,[12] demonstrando o uso de múltiplos métodos de transferência exoeletrogênica.
Na quelação de ferro, os compostos de óxido férrico insolúveis são dissolvidos em soluções aquosas. Como a biodisponibilidade do ferro é escassa, muitos micróbios secretam compostos quelantes de ferro para solubilizar, absorver e sequestrar o ferro para vários processos celulares. Certos exoeletrógenos têm mostrado a capacidade de usar tais compostos para transporte de elétrons solubilizando o ferro extracelularmente[10] e conduzindo-o à superfície da célula ou ao interior dela. Os componentes usados em cada via são filogeneticamente diversos.[11] Portanto, alguns agentes quelantes podem reduzir o ferro fora da célula agindo como lançadores de elétrons, enquanto outros podem conduzir ferro à célula para redução da membrana.[10]
Referências
- ↑ a b c d Logan B. (maio de 2009). «Exoelectrogenic bacteria that power microbial fuel cells». Nature Reviews Microbiology. 7: 375–383. PMID 19330018. doi:10.1038/nrmicro2113
- ↑ Willey J.; et al. (2011). Prescott's Microbiology. [S.l.]: McGraw Hill. pp. 228–245. ISBN 978-0-07-337526-7
- ↑ a b c Hartshorne R.; et al. (dezembro de 2009). «Characterization of an electron conduit between bacteria and the extracellular environment» (PDF). Proceedings of the National Academy of Sciences. 106: 22169–22174. doi:10.1073/pnas.0900086106
- ↑ a b c d Baron D. (outubro de 2009). «Electrochemical Measurement of Electron Transfer Kinetics by Shewanella oneidensis MR-1». The Journal of Biological Chemistry. 284: 28865–28873. PMC 2781432
 . PMID 19661057. doi:10.1074/jbc.M109.043455
. PMID 19661057. doi:10.1074/jbc.M109.043455
- ↑ a b Shi L.; et al. (2006). «Isolation of a High-Affinity Functional Protein Complex between OmcA and MtrC: Two Outer Membrane Decaheme c-Type Cytochromes of Shewanella oneidensis MR-1». Journal of Bacteriology. 188: 4705–4714. PMC 1483021
 . PMID 16788180. doi:10.1128/JB.01966-05
. PMID 16788180. doi:10.1128/JB.01966-05
- ↑ Logan B. (2008). Microbial Fuel Cells. [S.l.]: John Wiley & Sons Inc. pp. 4–6. ISBN 978-0470239483
- ↑ a b Flynn J.; et al. (2010). «Enabling Unbalanced Fermentations by Using Engineered Electrode-Interfaced Bacteria». mBio, American Society of Microbiology. 1: 1–8. PMC 2975363
 . PMID 21060736. doi:10.1128/mBio.00190-10
. PMID 21060736. doi:10.1128/mBio.00190-10
- ↑ a b Lovley D. (2008). «The microbe electric: conversion of organic matter to electricity». Current Opinion in Biotechnology. 19: 1–8. doi:10.1016/j.copbio.2008.10.005
- ↑ a b c Richter, Katrin; Schicklberger, Marcus; Gescher, Johannes (2012). «Dissimilatory Reduction of Extracellular Electron Acceptors in Anaerobic Respiration». Applied and Environmental Microbiology. 78: 913–921. PMC 3273014
 . PMID 22179232. doi:10.1128/AEM.06803-11
. PMID 22179232. doi:10.1128/AEM.06803-11
- ↑ a b c d Gralnick, Jeffrey A.; Newman, Dianne K. (julho de 2007). «Extracellular respiration». Molecular Microbiology. 65: 1–11. PMC 2804852
 . PMID 17581115. doi:10.1111/j.1365-2958.2007.05778.x
. PMID 17581115. doi:10.1111/j.1365-2958.2007.05778.x
- ↑ a b c Shi, Liang; Dong, Hailiang; Reguera, Gemma; Beyenal, Haluk; Lu, Anhuai; Liu, Juan; Yu, Han-Qing; Fredrickson, James K. (30 de agosto de 2016). «Extracellular electron transfer mechanisms between microorganisms and minerals». Nature Reviews Microbiology. 14 (10): 651–662. PMID 27573579. doi:10.1038/nrmicro.2016.93
- ↑ Leang C.; et al. (2010). «Alignment of the c-Type Cytochrome OmcS along Pili of Geobacter sulfurreducens». Applied and Environmental Microbiology. 76: 4080–4084. PMC 2893476
 . PMID 20400557. doi:10.1128/AEM.00023-10
. PMID 20400557. doi:10.1128/AEM.00023-10
