Hexametilfosforamida
| Hexametilfosforamida Alerta sobre risco à saúde | |
|---|---|
| |
| |
| Nome IUPAC | Hexamethylphosphoramide |
| Outros nomes | Hexametapol HMPA Tris(dimetilamida fosfórica) HMPT |
| Identificadores | |
| Número CAS | |
| PubChem | |
| ChemSpider | |
| KEGG | |
| ChEBI | |
| SMILES |
|
| InChI | 1/C6H18N3OP/c1-7(2)11(10,8(3)4)9(5)6/h1-6H3
|
| Propriedades | |
| Fórmula química | C6H18N3OP |
| Massa molar | 179.19 g mol-1 |
| Aparência | líquido claro, incolor[1] |
| Odor | aromático, suave, aminado[1] |
| Densidade | 1.03 g/cm3 |
| Ponto de fusão |
7.20 °C, 280 K, 45 °F |
| Ponto de ebulição |
232.5 °C, 506 K, 451 °F |
| Solubilidade em água | miscível[1] |
| Pressão de vapor | 0.03 mmHg (20°C)[1] |
| Riscos associados | |
| Classificação UE | |
| Principais riscos associados |
carcinógeno[1] |
| EUA Limite de exposição permissível (PEL) |
none[1] |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
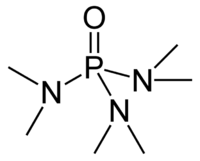
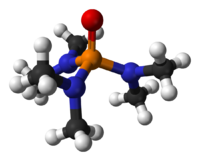
Hexametilfosforamida, frequentemente abreviada na literatura em inglês HMPA(de hexamethylphosphoramide) , é uma fosforamida (i.e. uma amida de ácido fosfórico) com a fórmula [(CH3)2N]3PO. Este líquido incolor é um solvente aprótico polar útil e aditivo em síntese orgânica.
Estrutura e reatividade[editar | editar código-fonte]
HMPA é o óxido da altamente básica fosfina tertiária triamida hexametilfosforosa (HMPT[nota 1]), P(NMe2)3. Como outros óxido de fosfina (e.g., óxido de trifenilfosfina), a molécula tem um centro tetraédrico e uma ligação P-O que é altamente polarizada, com carga negativa significativa residindo no átomo de oxigênio.
Compostos contendo uma ligação nitrogênio-fósforo tipicamente são degradados por ácido clorídrico formando uma amina protonada e fosfato.
Aplicações[editar | editar código-fonte]
HMPA é um solvente especialmente para polímeros, gases, e compostos organometálicos. Melhora a seletividade das reações de litiação por quebra dos oligômeros de bases de lítio tais como butil-lítio. Devido a HMPA solvatar seletivamente cátions, acelera de outra forma as lentas reações SN2 por geração de mais ânions "nus". Os centros de nitrogênio básicos no HMPA coordena fortemente o Li+.[2]
HMPA é um ligando nos reagentes úteis baseados em complexos de peróxido de molibdênio, e.g., MoO(O2)2(HMPA)(H2O) é usado como um oxidante em síntese orgânica.[3]
Reagentes alternativos[editar | editar código-fonte]
Sulfóxido de dimetilo pode frequentemente ser usado no lugar de HMPA como um solvente. Ambos são aceptores de ligação de hidrogênio fortes, e seus átomos de oxigênio ligam-se a cátions metálicos. Outras alternativas a HMPA incluem as tetra-alquilureias[4] e as alquilureias cíclicas como DMPU.[5]
Toxicidade[editar | editar código-fonte]
HMPA é apenas medianamente tóxico, mas demonstrou causar câncer nasal em ratos.[2] Ainda assim, muitos químicos orgânicos consideram a HMPA como uma molécula excepcionalmente perigosa devido à sua conhecida carcinogenicidade e evitam seu uso quando possível. A HMPA pode ser degradada em compostos menos tóxicos pela ação de ácido clorídrico. Para uso em laboratório, pode ser substituída pelo solvente menos carcinogênico DMI (1,3-dimetil-2-imidazolidinona).[6]
Notas
- ↑ De maneira confusa, algumas fontes (e.g., e-EROS) listam HMPT como uma abreviação para O=P(NMe2)3 (triamida hexametilfosfórica), assim como uma abreviação para P(NMe2)3 (triamida hexametilfosforosa).
Referências
- ↑ a b c d e f «NIOSH Pocket Guide to Chemical Hazards #0321 - Hexamethyl phosphoramide». National Institute for Occupational Safety and Health (NIOSH)
- ↑ a b Dykstra, R. R. (2001). «Hexamethylphosphoric Triamide». Encyclopedia of Reagents for Organic Synthesis. New York: John Wiley & Sons. doi:10.1002/047084289X.rh020
- ↑ Dickman, Michael H.; Pope, Michael T. (1994). «Peroxo and Superoxo Complexes of Chromium, Molybdenum, and Tungsten». Chemical Reviews. 94: 569–84. doi:10.1021/cr00027a002
- ↑ Beck, A. K.; Seebach, D. (2001). «N,N'-Dimethylpropyleneurea». Encyclopedia of Reagents for Organic Synthesis. New York: John Wiley & Sons. doi:10.1002/047084289X.rd366
- ↑ Mukhopadhyay, T.; Seebach, D. (1982). «Substitution of HMPT by the Cyclic Urea DMPU as a Cosolvent for highly Reactive Nucleophiles and Bases». Helvetica Chimica Acta. 65 (1): 385–391. doi:10.1002/hlca.19820650141
- ↑ Lo, C. C.; Chao, P. M. (1992). «Replacement of Carcinogenic Solvent HMPA by DMI in Insect Sex Pheromone Synthesis» (pdf). Journal of Chemical Ecology. 18 (2): 3245–3253. doi:10.1007/BF00982095
Ligações externas[editar | editar código-fonte]
- «Hexamethylphosphoramide CAS No. 680-31-9» (pdf). Report on Carcinogens, Twelfth Edition. National Toxicology Program, Department of Health and Human Services. 2011
- «Hexamethyl phosphoramide». NIOSH Pocket Guide to Chemical Hazards. Centers for Disease Control and Prevention, Department of Health and Human Services. 2011
- Merck Index, 12th Edition, 4761.
