Interação agóstica
Na química organometálica , a interação agóstica refere-se à interação de um metal de transição coordenativamente insaturado com uma ligação C − H , quando os dois elétrons envolvidos na ligação C − H entram no orbital d vazio do metal de transição, resultando em uma ligação três centros dois elétrons.[1] Muitas transformações catalíticas, por exemplo, adição oxidativa e eliminação redutiva, são propostas para ocorrer através de intermediários apresentando interações agósticas. Interações agósticas são observadas em toda a química organometálica em ligantes alquil, alquilideno e polienil.
História
[editar | editar código-fonte]O termo agóstico, derivado da palavra grega antiga para "manter-se próximo de si mesmo", foi cunhado por Maurice Brookhart e Malcolm Green, por sugestão do classicista Jasper Griffin, para descrever esta e muitas outras interações entre um metal de transição e uma ligação C-H . Freqüentemente, essas interações agósticas envolvem grupos alquil ou arila que são mantidos próximos ao centro do metal por meio de uma ligação σ adicional.[2][3]
Curtas interações entre substituintes de hidrocarbonetos e complexos metálicos coordenativamente insaturados foram observadas desde a década de 1960. Por exemplo, no dicloreto de tris (trifenilfosfina) rutênio, uma curta interação é observada entre o centro do rutênio (II) e um átomo de hidrogênio na posição orto de um dos nove anéis fenil.[4] Complexos de boroidreto são descritos como usando o modelo de ligação três centros dois elétrons.
A natureza da interação foi prenunciada na química de grupos principais na química estrutural do trimetilalumínio.
Características das interações agósticas
[editar | editar código-fonte]As interações agósticas são melhor demonstradas pela cristalografia. Dados de difração de nêutrons mostraram que as distâncias das ligações C − H e M┄H são 5-20% maiores do que o esperado para hidretos metálicos e hidrocarbonetos isolados. A distância entre o metal e o hidrogênio é normalmente 1,8–2,3 Å , e o ângulo M┄H−C está na faixa de 90°–140°. A presença de um sinal de RMN de 1H que é deslocado para cima daquele de um arilo ou alcano normal, frequentemente para a região normalmente atribuída a ligantes hidreto. A constante de acoplamento 1 J CH é normalmente reduzida para 70–100 Hz versus os 125 Hz esperados para uma ligação sp3 carbono-hidrogênio normal.

Força da interação
[editar | editar código-fonte]Com base em estudos experimentais e computacionais, a estabilização decorrente de uma interação agóstica é estimada em 10–15 kcal/mol. Cálculos recentes utilizando constantes de conformidade apontam para uma estabilização mais fraca (<10 kcal/mol).[6] Assim, as interações agósticas são mais fortes do que a maioria das ligações de hidrogênio. As ligações agósticas às vezes desempenham um papel na catálise, aumentando a 'rigidez' nos estados de transição. Por exemplo, na catálise Ziegler-Natta, o centro metálico altamente eletrofílico tem interações agósticas com a crescente cadeia polimérica. Esta rigidez aumentada influencia a estereosseletividade do processo de polimerização.
Interações relacionadas
[editar | editar código-fonte]
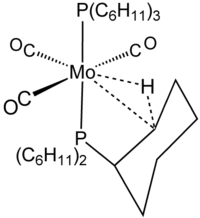
O termo agóstico é reservado para descrever interações de ligação de dois elétrons e três centros entre carbono, hidrogênio e um metal. A ligação tricentrada com dois elétrons está claramente implicada na complexação de H2, por exemplo, em W(CO)3(PCy3)2(H2), que está intimamente relacionado ao complexo agóstico mostrado na figura.[8] O silano se liga aos centros metálicos, muitas vezes por meio de interações Si┄H-M tricêntricas, do tipo agóstico. Porém, como essas interações não incluem carbono, elas não são classificadas como agásticas.
Ligações anagósticas
[editar | editar código-fonte]Certas interações M┄H−C não são classificadas como agósticas, mas são descritas pelo termo “anagóstica”. As interações anagósticas são de caráter mais eletrostático. Em termos de estruturas de interações anagósticas, as distâncias M┄H e os ângulos M┄H−C caem nas faixas de 2,3–2,9Å e 110°–170°, respectivamente.[2][9]
Função
[editar | editar código-fonte]
As interações agósticas desempenham uma função chave na estereoquímica de alcenos, bem como na inserção migratória durante reações de polimerização de alcenos para produzir materiais plásticos, tais como o polietileno e o polipropileno.
Ver também
[editar | editar código-fonte]Referências
- ↑ IUPAC, Compêndio de Terminologia Química, 2ª ed. ("Gold Book"). Compilado por A. D. McNaught e A. Wilkinson. Blackwell Scientific Publications, Oxford (1997). Versão online: "{{{título}}}" (2006–) criado por M. Nic, J. Jirat, B. Kosata; atualizações compiladas por A. Jenkins. ISBN 0-9678550-9-8.
- ↑ a b Brookhart, Maurice; Green, Malcolm L. H. (1983). «Carbon-hydrogen-transition metal bonds». J. Organomet. Chem. 250: 395–408. doi:10.1016/0022-328X(83)85065-7.
- ↑ Brookhart, Maurice; Green, Malcolm L. H.; Parkin, Gerard (2007). «Agostic interactions in transition metal compounds». Proc. Natl. Acad. Sci. 104 (17): 6908–14. Bibcode:2007PNAS..104.6908B. PMC 1855361
 . PMID 17442749. doi:10.1073/pnas.0610747104
. PMID 17442749. doi:10.1073/pnas.0610747104

- ↑ La Placa, Sam J.; Ibers, James A. (1965). «A Five-Coordinated d6 Complex: Structure of Dichlorotris(triphenylphosphine)ruthenium(II)». Inorg. Chem. 4 (6): 778–783. doi:10.1021/ic50028a002
- ↑ Z. Dawoodi; M. L. H. Green; V. S. B. Mtetwa; K. Prout; A. J. Schultz; J. M. Williams; T. F. Koetzle (1986). «Evidence for Carbon–Hydrogen–Titanium Interactions: Synthesis and Crystal Structures of the Agostic alkyls [TiCl3(Me2PCH2CH2PMe2)R] (R = Et or Me)». J. Chem. Soc., Dalton Trans. (8): 1629. doi:10.1039/dt9860001629
- ↑ Von Frantzius, Gerd; Streubel, Rainer; Brandhorst, Kai; Grunenberg, Jörg (2006). «How Strong is an Agostic Bond? Direct Assessment of Agostic Interactions Using the Generalized Compliance Matrix». Organometallics. 25 (1): 118–121. doi:10.1021/om050489a
- ↑ Nikonov, G. I. (2005). «Recent Advances in Nonclassical Interligand SiH Interactions». Adv. Organomet. Chem. Advances in Organometallic Chemistry. 53: 217–309. ISBN 9780120311538. doi:10.1016/s0065-3055(05)53006-5
- ↑ Kubas, G. J. (2001). Metal Dihydrogen and σ-Bond Complexes. New York: Kluwer Academic. ISBN 978-0-306-46465-2
- ↑ Braga, D.; Grepioni, F.; Tedesco, E.; Biradha, K.; Desiraju, G. R. (1997). «Hydrogen Bonding in Organometallic Crystals. 6. X−H┄M Hydrogen Bonds and M┄(H−X) Pseudo-Agostic Bonds». Organometallics. 16 (9): 1846–1856. doi:10.1021/om9608364
