Rubreno
| Rubreno Alerta sobre risco à saúde | |
|---|---|
| |

| |

| |
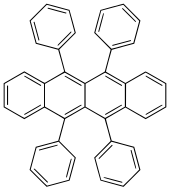
| Nome IUPAC | 5,6,11,12-Tetraphenyltetracene |
| Outros nomes | 5,6,11,12-Tetrafenilnaftaceno, 5,6,11,12-Tetrafeniltetraceno |
| Identificadores | |
| Número CAS | |
| PubChem | |
| Número EINECS | |
| ChemSpider | |
| SMILES |
|
| InChI | 1/C42H28/c1-5-17-29(18-6-1)37-33-25-13-14-26-34(33)39(31-21-9-3-10-22-31)42-40(32-23-11-4-12-24-32)36-28-16-15-27-35(36)38(41(37)42)30-19-7-2-8-20-30/h1-28H
|
| Propriedades | |
| Fórmula molecular | C42H28 |
| Massa molar | 532.7 g/mol |
| Ponto de fusão |
315 °C, 588 K, 599 °F |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
Rubreno (5,6,11,12-tetrafeniltetraceno) é um hidrocarboneto aromático policíclico de coloração avermelhada. Rubreno é usado como um sensibilizador em quimioluminescência e como uma fonte de luz amarela em bastões, pulseiras e outros objetos luminescentes (em inglês, lightsticks).
Propriedades eletrônicas[editar | editar código-fonte]
Como um semicondutor orgânico, a principal aplicação de rubreno é em diodos emissores de luz orgânicos (OLEDs) e transistores orgânicos de efeito de campo, os quais são os elementos centrais das telas flexíveis. Transistores de cristal único podem ser preparados usando rubreno cristalino, o qual é cultivado em um forno de zona modificado em um gradiente de temperatura. Esta técnica, conhecida como transporte físico de vapor, foi introduzida em 1998.[1][2]
Rubreno possui a distinção de ser o semicondutor orgânico com a maior mobilidade de transporte, atingindo 40 cm2/(V·s) para lacunas de elétrons. Este valor foi medido em OFETs preparados por descasque de uma fina camada de rubrene monocristalino e transferência para um substrato de Si/SiO2.[3]
Estrutura cristalina[editar | editar código-fonte]
Vários polimorfismos de rubreno são conhecidos. Os cristais crescidos a partir do vapor no vácuo podem apresentar padrões monoclinicos,[4] triclinicos,[5] e ortorrômicos.[6] Os cristais ortorrômicos (grupo espacial Bbam) são obtidos em um sistema fechado em um forno de duas zonas à pressão ambiente.[7]
Síntese[editar | editar código-fonte]
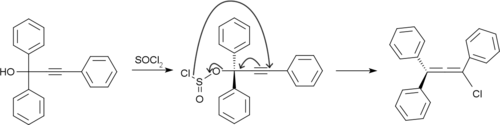
Rubreno é preparado por tratar 1,1,3-trifenilprop-2-ino-1-ol com cloreto de tionila.[8]
O cloroaleno resultante sofre dimerização e desidrocloração resultando em rubreno.[9]
Propriedades redox[editar | editar código-fonte]
Rubreno, como outras moléculas aromáticas policíclicas, sofre reações redox em solução. Oxida-se e reduz-se reversivelmente a 0.95 V e −1.37 V, respectivamente vs SCE. Quando o cátion e o ânion são co-gerados em uma célula eletroquímica, eles podem combinar-se com a aniquilação de suas cargas, mas produzindo uma molécula de rubreno excitada que emite em 540 nm. Este fenômeno é chamado eletroquimioluminescência.[10]
Referências
- ↑ Laudise, R.A; Kloc, Ch; Simpkins, P.G; Siegrist, T (1998). «Physical vapor growth of organic semiconductors». Journal of Crystal Growth. 187 (3–4). 449 páginas. doi:10.1016/S0022-0248(98)00034-7
- ↑ Jurchescu, Oana Diana (2006) «"Low Temperature Crystal Structure of Rubrene Single Crystals Grown by Vapor Transport"» (PDF). dissertations.ub.rug.nl. Consultado em 17 de dezembro de 2017. Arquivado do original (PDF) em 25 de fevereiro de 2012 in Molecular organic semiconductors for electronic devices, PhD thesis Rijksuniversiteit Groningen.
- ↑ Hasegawa, Tatsuo and Takeya, Jun (2009). «Organic field-effect transistors using single crystals». Sci. Technol. Adv. Mater. 10 (2): 024314. Bibcode:2009STAdM..10b4314H. PMC 5090444
 . doi:10.1088/1468-6996/10/2/024314
. doi:10.1088/1468-6996/10/2/024314
- ↑ Taylor, W. H. (1936). «X-ray measurements on diflavylene, rubrene, and related compounds». Zeitschrift für Kristallographie. 93: 151. doi:10.1524/zkri.1936.93.1.151
- ↑ Akopyan, S. A.; Avoyan, R. L. and Struchkov, Yu. T. Z. Strukt. Khim. 3, 602 (1962)
- ↑ Henn, D. E. & Williams, W. G. (1971). «Crystallographic data for an orthorhombic form of rubrene». J. Appl. Cryst. 4 (3): 256. doi:10.1107/S0021889871006812
- ↑ Bulgarovskaya, I.; Vozzhennikov, V.; Aleksandrov, S.; Belsky, V. (1983). Latv. PSR Zinat. Akad. Vestis, Fiz. Teh. Zinat. Ser. 4. 53: 115
- ↑ Furniss, B. Vogel's Textbook of Practical Organic Chemistry 5th ed. [S.l.: s.n.] pp. 840–841
- ↑ Furniss, B. Vogel's Textbook of Practical Organic Chemistry 5th ed. [S.l.: s.n.] pp. 844–845
- ↑ Richter, M. M. (2004). «Electrochemiluminescence (ECL)». Chemical Reviews. 104 (6): 3003–36. PMID 15186186. doi:10.1021/cr020373d