Tri-iodeto de fósforo
| Triiodeto de fósforo Alerta sobre risco à saúde | |
|---|---|
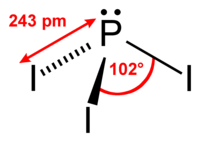
| |

| |
| Nome IUPAC | Triiodeto de fósforo Iodeto de fósforo(III) |
| Outros nomes | Triiodofosfina |
| Identificadores | |
| Número CAS | |
| PubChem | |
| ChemSpider | |
| SMILES |
|
| InChI | 1/I3P/c1-4(2)3
|
| Propriedades | |
| Fórmula molecular | PI3 |
| Massa molar | 411.68717 g/mol |
| Aparência | sólido vermelho escuro |
| Densidade | 4.18 g/cm3 |
| Ponto de fusão |
61,2 °C |
| Ponto de ebulição |
200 °C (decomp.) |
| Solubilidade em água | decompõe-se |
| Estrutura | |
| Forma molecular | Trigonal piramidal |
| Riscos associados | |
| Classificação UE | não listado |
| NFPA 704 | |
| Ponto de fulgor | não-inflamável |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
Triiodeto de fósforo (PI3) é um sólido vermelho instável que reage violentamente com a água. É um engano comum[1] afirmar que o PI3 é instável demais para ser armazenado; de fato, é disponível comercialmente. é largamente usado em química orgânica para converter álcoois em iodetos de alquila. É ainda um poderoso agente redutor. Note que o fósforo também forma um iodeto inferior, P2I4, mas a existência de PI5 é duvidosa a temperatura ambiente.
Propriedades
[editar | editar código-fonte]PI3 tem essencialmente momento de dipolo zero em solução no dissulfeto de carbono, porque a ligação P-I tem quase nenhum dipolo. A ligação P-I é também fraca; PI3 é muito menos estável que o PBr3 e o PCl3, com uma entalpia de formação para o PI3 de apenas −46 kJ/ mol (sólido)., frequentemente pela adição de iodo a uma solução de fósforo branco em dissulfeto de carbono:
- P4 + 6 I2 → 4 PI3
Alternativamente, PCl3 pode ser convertido em PI3 pela ação do iodeto de hidrogênio ou certos iodetos metálicos.
Usos
[editar | editar código-fonte]Triiodeto de fósforo é comumente usado no laboratório para a conversão de álcoois primários ou secundários em iodetos de alquila.[2] O álcool é frequentemente usado como o solvente, além de ser o reagente. Geralmente o PI3 é preparado in situ pela reação de fósforo vermelho com iodo na presença de álcool; por exemplo, a conversão de metanol em iodometano:[3]
- PI3 + 3 {{CH3OH}} → 3 {{CH3I}} + {{H3PO3}}
Esses iodetos de alquila são compostos úteis para reações de substituição nucleofílica, e para a preparação de reagentes de Grignard.
Referências
[editar | editar código-fonte]- ↑ L. G. Wade, Jr., Organic Chemistry, 6th ed., p. 477, Pearson/Prentice Hall, Upper Saddle River, New Jersey, USA, 2005.
- ↑ B. S. Furnell et al., Vogel's Textbook of Practical Organic Chemistry, 5th edition, Longman/Wiley, New York, 1989.
- ↑ King, C. S.; Hartman, W. W. (1943). «Methyl Iodide». Org. Synth.; Coll. Vol., 2

