Usuário(a):Pil2031/Testes
Esta é uma página de testes de Pil2031, uma subpágina da principal. Serve como um local de testes e espaço de desenvolvimento, desta feita não é um artigo enciclopédico. Para uma página de testes sua, crie uma aqui. Como editar: Tutorial • Guia de edição • Livro de estilo • Referência rápida Como criar uma página: Guia passo a passo • Como criar • Verificabilidade • Critérios de notoriedade |
Mirmecofagia[editar | editar código-fonte]

Mirmecofagia é o hábito alimentar de ingerir formigas e/ou cupins. Está associada a diversas espécies animais distintas e até em algumas sociedades humanas. No caso dos
animais, existem mirmecófagos em todos os continentes tropicais e eles podem ser divididos em obrigatórios ou oportunistas.[1]
Esse hábito está presente tanto em animais vertebrados quanto em Invertebrados, e os principais predadores de formigas e cupins são outras formigas e mamíferos [2]. Por formigas e cupins serem insetos eusociais, e formarem grandes agrupamentos em ninhos densos, os animais que os exploram apresentam adaptações semelhantes para possibilitar a predação [3]. A mirmecofagia é observada em diferentes grupos taxonômicos de vertebrados, consistindo, portanto, em um caso de convergência de um papel ecológico, em alguns casos acompanhado de convergência adaptativa [4].
Grupos mirmecofágos[editar | editar código-fonte]
A Família Myrmecophagidae é atualmente composta de dois gêneros, Myrmecophaga Linnaeus, 1758 e Tamanduá Gray, 1825. Onde a grande parte das características diagnósticas do grupo estão associadas às adaptações para a mirmecofagia.[5]
A mirmecofagia em Primatas é principalmente descrito em chimpanzés, gorilas e macacos-pregos. [6][7] Na América Central, macacos-pregos predam colônias de Pseudomyrmex belti, [8] embora seja um evento raro está mesma espécie de primata pode também utilizar formigas do gênero Azteca.[8]
Em algumas famílias de anuros apresentam a mirmecofagia como um traço coevolutivo [9][10]
Cabassous, conhecidos como tatu de rabo mole devido a pouca dispersão de osteodermos na cauda, possui como hábito alimentar a mirmecofagia, alimentam-se apenas de formigas e térmitas. [11]
Espécies representativas[editar | editar código-fonte]

Tamanduá-bandeira[editar | editar código-fonte]
O Tamanduá-bandeira (nome científico: Myrmecophaga tridactyla) é um mamífero xenartro, maior representante da família Mirmecophagidae. Podendo atingir 2,1 metros de comprimento total e o peso pode de 45 kg.[12]
É facilmente reconhecido por seu focinho tubular e comprido, muito bem adaptado ao modo de vida mirmecofagídeo, e por sua pelagem característica, densa e com padrão característico.
Os membros anteriores são fortemente musculosos e possuem quatro dedos com três garras fortes e grandes, que são úteis para que o animal possa destruir os ninhos/formigueiros/cupinzeiros e ter acesso a sua presa. Sendo que a garra do terceiro dedo é a maior. Enquanto os membros posteriores apresentam cinco dedos com unhas curtas. [13] Além disso, eles também apresentam redução de dentes.
Terrestres, com hábitos diurnos e noturnos, habitam variadas fitofisionomias, desde formações florestais até campos.[12]
O Tamanduá-bandeira está entre os animais listados pela IUCN "vulneráveis". [12]

Pangolim[editar | editar código-fonte]
O Pangolim é um mamífero que vive em zonas tropicais da Ásia e da África. Há sete espécies diferentes, as únicas representantes da família Manidae e ordem Pholidota.
O tamanho do pangolim varia de 30 a 100 cm. E as fêmeas costumam ser menores menores que os machos.[14]
O corpo é todo coberto por escamas que fornecem proteção contra lesões e reduz a vulnerabilidade do pangolim à infecção.[15] Seu coro é tão flexível que esses animais possuem a habilidade de se enrolar como uma bola em situações de perigo. A língua dos pangolins é extremamente alongada, pode ser redonda ou achatada e se estender até a cavidade abdominal.[16]
As garras das patas dianteiras do animal têm um comprimento extraordinariamente longo que são utilizadas para escavar e escalar árvores.[14]
O Pangolim malaio e o pangolim chinês são classificados como criticamente ameaçados de extinção pela Lista Vermelha da IUCN de Espécies Ameaçadas[17]
Mirmecofagídeos oportunistas e obrigatórios[editar | editar código-fonte]
A imensa abundância de formigas e cupins em praticamente todas as partes do mundo propiciam que sejam uma fonte de alimento potencial para muitos predadores. Alguns mirmecófagos podem ser oportunistas, ingerindo além de formigas, cupins, outros insetos, minhocas, pequenos vertebrados e frutas. Um exemplo é o caso do urso negro (Ursus americanus), que tem como dieta preferencial frutas, amplamente disponíveis durante o verão; entretanto, durante períodos em que as frutas não estão disponíveis, ele se alimenta de formigas[18]. Neste caso, o animal vai consumir uma presa em particular de acordo com a sua disponibilidade no ambiente. Contudo, existem espécies que comem exclusivamente formigas ou cupins, como o tamanduá-bandeira[1]. Ainda, em alguns casos, o consumo de formigas e também outros insetos é mantido, em menor quantidade, paralelamente à ingestão de outros alimentos, possivelmente para suprir alguma necessidade nutricional não encontrada em outros componentes da dieta [18].
Adaptações morfológicas dos mirmecofagídeos[editar | editar código-fonte]
A principal característica é a presença de uma língua longa, esguia, cilíndrica e viscosa utilizada na exploração dos cupinzeiros e formigueiros para obtenção do alimento. A presença de papilas na superfície lingual é uma característica ainda conflitante, por conseguinte encontra-se trabalhos onde a língua é descrita como uma superfície lisa, sem papilas, com exceção de duas papilas valadas, enquanto que em outros são relatadas também papilas filiformes (ou cônicas), principalmente no ápice lingual.[5]
Os gêneros da família Myrmecophagidae apresentam a língua em formato vermiforme e uma protuberância globosa no ápice lingual. Além de papilas foliadas e papilas fungiforme e epitélio fortemente queratinizado no ápice.[5]
As papilas valadas apresentam no centro duas ou três papilas secundárias. No entanto, as papilas valadas em Myrmecophaga apresentam forma ovalada e com as paredes que circundam as papilas secundárias, mais desenvolvidas e evidentes que em Tamanduá, no qual as papilas variam de ovaladas à forma de fenda, com as paredes circundantes mais sutis e menos demarcadas em relação ao restante da língua.[5]
As papilas filiformes da língua de Myrmecophaga são sempre simples, ao passo que no ápice e região adjacente, as papilas filiformes de Tamanduá são em quase sua totalidade compostas, possuindo um ou dois projeções acessórias.[5]
Aspectos genéticos[editar | editar código-fonte]
Em Pangolim o interferon épsilon (IFNE), exclusivamente expresso em células epiteliais e importante na imunidade da pele e da mucosa perdeu sua função em todas as espécies africanas e asiáticas de pangolim, talvez impactando a resistência à infecção. [15]
O desenvolvimento de escamas talvez seja uma inovação que forneça proteção contra lesões ou estresses e reduza a vulnerabilidade do pangolim à infecção. Evidências adicionais de adaptações especializadas foram evidenciadas a partir de genes selecionados positivamente envolvendo vias relacionadas à imunidade, inflamação, armazenamento e metabolismo de energia, sistemas musculares e nervosos e desenvolvimento de escamas e cabelos.[15]
As famílias de genes de receptores olfativos são significativamente expandidas em pangolins, refletindo seu sistema de olfação bem desenvolvido.[15]
O sentido do olfato está intimamente relacionado à atividade biológica de comportamentos instintivos, e como pangolins possuem uma visão não tão eficiente, o olfato desenvolve papel importante na alimentação com o reconhecimento específico de cheiros. Um total de 969 genes foram associados com a transdução olfativa nos transcritos de M. javanica, 942 transcritos dos quais foram anotados como vários tipos de receptores olfativos. Essas descobertas podem explicar o agudo olfato em M. javanica.[19]
Apesar dos pangolins serem mamíferos sem dentes, eles possuem 107 genes relacionados ao desenvolvimento dentário. E três destes são pseudogenizados, o que significa que perderam sua função.[15]
Os Pangolins são principalmente noturnos e acredita-se que tenham uma visão ruim[16]. Foram encontrados 217 genes relacionados à visão, sendo que vários destes perderam sua função.[15]
Características Químicas[editar | editar código-fonte]

Habrocestum pulex, uma aranha mirmecófaga da América do Norte, aparentemente responde a sinais químicos de formigas. Habrocestum pulex vive em serrapilheira, um microhabitat no qual numerosas obstruções visuais podem frequentemente impedir a detecção visual precoce de presas. A habilidade para detectar sinais químicos de formigas pode desempenham um papel importante na preparação da H. pulex para responder adequadamente a suas presas[20]
Habrocestum pulex aparentemente detecta e responde de forma adaptativa a sinais químicos de formigas. Elas escolhem permanecer em solo contendo sinais químicos de formigas, que estimulam a H. pulex a adotar postura e comportamento adequado para capturar formigas, mesmo na ausência de pistas ópticas de formigas. Além disso, os sinais químicos derivados de formigas no solo aumentam a atenção da pulex para pistas ópticas de formigas. [20]
Em vez de demonstrar respostas a espécies de formigas em particular das quais H. pulex preda mais frequentemente na natureza resultados sugerem que H. pulex evoluiu a capacidade de detectar e responder de forma adaptativa a produtos químicos secretados por uma gama mais ampla de formigas.[20]
Importância ecológica(controle de insetos)[editar | editar código-fonte]
O hábito da mirmecofagia tem como resultado o controle da população dos insetos que são predados. Um único pangolim adulto pode consumir até 70 milhões de insetos a cada ano, e tem um papel relevante no controle de algumas espécies de cupins. [21]
Existem plantas de diversos táxons chamadas de mirmecófitas por apresentarem estruturas especializadas que têm como única função conhecida abrigar colônias de formigas(domácias). Essas plantas dependem fortemente da associação com as formigas para a defesa contra herbívoros, de modo que as mesmas não atingiram a maturidade reprodutiva sem a presença de formigas associadas. [22][23]
Evolução do hábito/Quantas vezes o hábito surgiu?[editar | editar código-fonte]
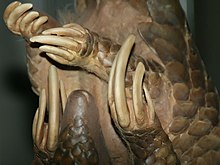
Em mamíferos a mirmecofagia obrigatória surgiu ao menos cinco vezes. Três vezes em mamífero placentários, uma vez em marsupiais e uma vez em monotremados. No caso dos mamíferos placentários, não houve apenas a convergência de um papel ecológico, mas também de adaptações morfológicas que permitem a exploração de formigas e cupins. Tanto o tamanduá-bandeira (Myrmecophaga tridactyla) que habita a América do Sul, quanto o porco formigueiro (Orycteropus afer) oriundo da África, e o pangolim-gigante (Manis gigantea) asiático possuem garras longas, membros anteriores bem desenvolvidos, focinho em forma de tubo e redução ou ausência dos dentes. Todas essas são características morfológicas associadas ao hábito da mirmecofagia.[4]
Em outros amniotas, a mirmecofagia também surgiu três vezes independentemente em répteis, e há evidências de que o hábito tenha surgido também em terópodes, como no Shuvuuia deserti, que apresentava adaptações morfológicas relacionadas à mirmecofagia, e viveu durante o período cretáceo. Como formigas se tornaram mais abundantes em ambientes terrestres a partir do eoceno, o Shuvuuia deserti seria, portanto, não especializado em comer apenas formigas, mas também se alimentava de cupins. [4][24]
Mirmecofagia na alimentação humana[editar | editar código-fonte]
Existem diversas culturas ditas “não ocidentais” pelo mundo onde existe o hábito de utilizar formigas na alimentação. Exemplos são algumas regiões no interior do Brasil, como Bahia, Minas Gerais e Pernambuco. Formigas tanajura ou içá (Atta sp.) são preparadas retirando-se o abdômen e fritando-o em óleo ou manteiga. Pode-se ou não adicionar farinha. É um hábito mais aceitável entre crianças, pois muitos adultos que já experimentaram formigas perderam o hábito ou por vergonha ou por mais opções na alimentação.[25]
Comparação de valores protéicos de diferentes espécies de formigas com alimentos comuns à nossa dieta: fêmea fértil da saúva Atta cephalotes (42,59%), carne de frango (23%) e carne bovina (20%).[26] Na China, a formiga tecelã Oecophylla smaragdina contém de 42% a 67% de proteínas, é rica em aminoácidos, sais minerais e vitaminas, possui alta concentração de zinco, o que a torna benéfica para o crescimento e desenvolvimento humano.[27]
Referências[editar | editar código-fonte]
- ↑ a b Redford, K. H. 1986. Dietary specialization and variation in two mammalian myrmecophages (variation in mammalian myrmecophagy). Revista Chilena de Historia Natural 59: 201–208.
- ↑ Redford, K. H. 1987. Ants and termites as food – patterns of mammalian myrmecophagy. Current Mammalogy 1: 349–399.
- ↑ Crompton, John (1954). Ways of the Ant. Collins. ISBN 9780941130844.
- ↑ a b c McGhee, G.2 (2011) Convergent Evolution: Limited Forms Most Beautiful (Vienna Series in Theoretical Biology). The MIT Press.
- ↑ a b c d e CASALI, D. M. ; PERINI, F. A. . Considerações sobre a anatomia da língua de Myrmecophagidae (Xenarthra:Vermilingua). In: 8º Congresso Brasileiro de Mastozoologia, 2015, João Pessoa. 8º Congresso Brasileiro de Mastozoologia - Livro de resumos, 2015. p. 33-34.
- ↑ Rose, L.M. 1997. Vertebrate Predation and Food-Sharing in Cebus and Pan. International Journal of Primatology, 18:727-765
- ↑ Ganas, J. & Robbins, M. M. 2004. Intrapopulation differences in ant eating in the mountain gorillas of Bwindi Impenetrable National Park, Uganda. Primates 45:275-278
- ↑ a b Freese, C. 1976. Predation on swollen-thorn Acacia ants by white-faced monkeys. Cebus capucinus. Biotropica. 8:278-281
- ↑ Caldwell, J.P. 1996. The evolution of myrmecophagy and its correlates in poison frogs (Family Dendrobatidae). Journal of Zoology 240: 75-101.
- ↑ Darst, C.R., P.A. Menéndez-Guerrero, L.A. Coloma e D.C. Cannatella. 2005. Evolution of dietary specialization and chemical defense in poison frogs (Dendrobatidae): A comparative analysis. The American Naturalist 165: 56-69.
- ↑ Redford, K.H. Food habitats of armadillo (Xenarthra:Dasypodidae). In: The evolution and ecology of armadillos, sloths and vermilinguas edited by Montgomery, G. G., 429-437 Washington and London: Smithsonian Institution Press, 1985
- ↑ a b c Chiquito, E.A. & Percequillo, A.R. 2009. Myrmecophaga tridactyla (Linnaeus, 1758) Pilosa, Myrmecophagidae. P. 45. In: Bressan, M.; Kierulff, M.C.M. & Sugieda, A.M (coord.). Fauna Ameaçada de Extinção no Estado de São Paulo: Vertebrados. Fundação Parque Zoológico de São Paulo/Secretaria de Meio Ambiente, São Paulo. 645p.
- ↑ Reis, N.R.; Peracchi, A.L.; Pedro, W.A.; Lima, I.P. Mamíferos do Brasil. 2.ed. Londrina: Nélio R. dos Reis, 2011. 439p
- ↑ a b Ganguly S: Pangolin- zoological characteristics and its uniqueness in mammalian group. J Entomol Zool Stud 2013, 1(1):1–2.
- ↑ a b c d e f Choo SW , Rayko M, Tan TK, Hari R, Komissarov A, Wee WYet al. Pangolin genomes and the evolution of mammalian scales and immunity. Genome Res . 2016. doi:10.1101/gr.203521.115.
- ↑ a b Soewu DA, Ayodele IA. 2009. Utilisation of Pangolin (Manis sps) in traditional Yorubic medicine in Ijebu province, Ogun State, Nigeria. J Ethnobiol Ethnomed 5: 39.
- ↑ «THE IUCN RED LIST OF THREATENED SPECIES». International Union for Conservation of Nature and Natural Resources. Consultado em 19 de Outubro de 2018
- ↑ a b Noyce, K. V., Kannowski, P. B., & Riggs, M. R. (1997). Black bears as ant-eaters: seasonal associations between bear myrmecophagy and ant ecology in north-central Minnesota. Canadian Journal of Zoology, 75(10), 1671–1686. doi:10.1139/z97-794
- ↑ J.-E. Ma, L. M. Li, H. Y. Jiang, X. J. Zhang, J. Li, G. Y. Li, L. H. Yuan, J. Wu, J. P. Chen, Transcriptomic analysis identifies genes and pathways related to myrmecophagy in the Malayan pangolin (Manis javanica). PeerJ 5, e4140 (2017).
- ↑ a b c Clark, R. J., Jackson, R. R., & Cutler, B. (2000). CHEMICAL CUES FROM ANTS INFLUENCE PREDATORY BEHAVIOR IN HABROCESTUM PULEX, AN ANT-EATING JUMPING SPIDER (ARANEAE, SALTICIDAE). Journal of Arachnology, 28(3), 309–318. doi:10.1636/0161-8202(2000)028[0309:ccfaip]2.0.co;2
- ↑ Hua, L., Gong, S., Wang, F., Li, W., Ge, Y., Li, X., & Hou, F. (2015). Captive breeding of pangolins: current status, problems and future prospects. ZooKeys, (507), 99–114. Advance online publication. http://doi.org/10.3897/zookeys.507.6970
- ↑ Beattie, A.J. 1985. The evolutionary ecology of ant-plant mutualisms. Cambridge University Press., Cambridge. 173 pp.
- ↑ Benson, W.W. 1985. Amazon ant-plants. In: Prance, G. T. & T.E.Lovejoy (Eds). Amazonia. Pergamon Press, Oxford, p. 239-266
- ↑ Longrich , N. R. , and P. J. Currie . 2008 . Albertonykus borealis , a new alvarezsaur (Dinosauria:Theropoda) from the Early Maastrichtian of Alberta, Canada: Implications for the systematics and ecology of the Alvarezsauridae. Cretaceous Research 30 ( 1 ): 239 – 252
- ↑ HERMÓGENES, GABRIELLA CARVALHO (2016). «Uso alimentar e medicinal de insetos em comunidades rurais do sul da Bahia: uma abordagem etnozoológica» (PDF). UNIVERSIDADE ESTADUAL DE SANTA CRUZ DEPARTAMENTO DE CIÊNCIAS BIOLÓGICAS -
DCB PROGRAMA DE PÓS - GRADUAÇÃO EM ZOOLOGIA. Consultado em 24 de outubro de 2018 line feed character character in
|publicado=at position 74 (ajuda) - ↑ CONCONI, J. R. E., RODRÍGUEZ, H. B. (1977). Valor nutritivo de ciertos insectos comestibles de México y lista de algunos insectos comestibles del mundo. México: Anales del Instituto de Biología de la UNAM, Serie Zoología, v. 48. pp. 165–186
- ↑ CHEN, Y. (1994). Ants used as food and medicine in China. China: The Food Insects Newsletter, v. 7, n. 2. pp. 8–10


