Adição nucleofílica
Este artigo ou secção contém uma lista de referências no fim do texto, mas as suas fontes não são claras porque não são citadas no corpo do artigo, o que compromete a confiabilidade das informações. (Novembro de 2012) |
Em química orgânica, uma adição nucleofílica é uma reação de adição onde em um composto químico insaturado (ligação dupla ou tripla) reage com um nucleófilo, resultando em na formação de um composto saturado.[1] Nesta reação, a ligação π do substrato dá origem a duas novas ligações covalentes.
As reações de adição estão limitadas a compostos químicos que tenham átomos unidos por ligações múltiplas:
- Moléculas com ligações múltiplas carbono-heteroátomo como os carbonilos, as iminas ou os nitrilas.
- Moléculas com ligações duplas ou triplas carbono-carbono (quando possuem características de eletrófilos).
Adição nucleófila em ligações duplas carbono-heteroátomo[editar | editar código-fonte]
As reações de adição de um nucleófilo sobre ligações duplas carbono-heteroátomo tais como o C=O ou o C=N mostram uma ampla variedade. Estas ligações são polares (existe uma diferença de eletronegatividade significativa entre os dois átomos que os formam), de tal forma que o carbono suporta uma carga parcial positiva. Isto faz que este átomo seja o objetivo do nucleófilo.

Este tipo de reação também é conhecida como adição nucleófila 1,2 ou adição 1,2.[2]
Em relação à estereoquímica deste tipo de ataque nucleófilo o produto da reação, na ausência de quiralidade prévia na molécula, é o racemato, salvo quando se tem um centro quiral na α ao carbono nucleófilo e nos sistemas cíclicos ou policíclicos onde temos faces diferenciadas, produzindo-se em geral nestes casos o ataque do nucleófilo majoritariamente pela face menos impedida.
Adição a grupos carbonila[editar | editar código-fonte]
A adição a uma carbonila pode ocorrer com diferentes nucleófilos:
água: reação de hidratação forma um diol geminal (hidrato)
álcool: reação de acetalização forma um acetal
hidreto: reação de redução a um álcool
amina com formaldeído: reação de Mannich forma um composto de carbonilado
íon enolato: reação aldol ou reação de Baylis – Hillman forma aldol ou uma cetona a,b-insaturada
nucleófilo organometálico: reação de Grignard ou a reação de Barbier relacionada ou uma reação de Reformatskii forma um álcool
iletos como um reagente de Wittig ou o reagente de Corey-Chaykovsky ou carbaniões de α-silil na olefinação de Peterson
um carbânion fosfonato: reação de Horner-Wadsworth-Emmons
uma zwitterion de piridina: reação de Hammick
um acetileto: reações de alcinilação.
um íon cianeto: nas reações de cianoidrina
Formação de Iminas[editar | editar código-fonte]
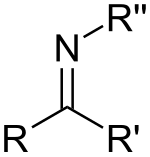
Uma imina é composto orgânico ou grupo funcional com estrutura geral RR'C=NR, onde R pode ser um H ou um grupo orgânico, sendo neste último caso conhecida também como base de Schiff.
Imina:
As iminas são formadas através de uma reação entre uma amina primária com uma cetona ou um aldeído, podendo apresentar isomeria Z/E, sendo esta relacionada ao impedimento estérico da molécula.
Mecanismo: A formação de uma imina se inicia através da adição nucleófila da amina sobre o carbonilo eletrófilo do aldeído ou cetona, normalmente com o uso de catálise ácida, formando-se um hemiaminal como intermediário. Em sequência, o hemiaminal formado elimina uma molécula de água, formando assim a imina.
Ver também[editar | editar código-fonte]
Referências
- K. Peter C. Vollhardt; Química Orgánica; Barcelona: Ediciones Omega S.A., 1994; ISBN 84-282-0882-4
- Fogaça, Jennifer. Brasil Escola. Disponível em :<>http://www.brasilescola.com/quimica/ozonolise-alcenos.htm>. Copyright © 2002-2013. Acessado em 10 de Agosto de 2013.