Dipolo
Dipolo de uma molécula é um dipolo elétrico com um campo eléctrico inerente decorrente de uma diferença de eletronegatividade.
O físico e químico Peter Debye foi o primeiro cientista a estudar os dipolos moleculares exaustivamente e, devido a isso, foi homenageado com a unidade dada ao mensuração do momento dipolar, Debye.
O momento dipolo pode ser obtido a partir de medições da constante dielétrica.[1] Entretanto, essa propriedade pode ser aproximada como uma soma vetorial dos respectivos momentos dipolo da molécula. É necessário levar em consideração a geometria molecular para a soma vetorial. Moléculas com polos identificáveis possuem o momento dipolo não nulo e, por isso, são moléculas polares.
Tipos[editar | editar código-fonte]
Existem três tipos de dipolos, também conhecidos como Forças de Van der Waals:
- Dipolo permanente: Ocorre em moléculas polares e é decorrente da diferença de eletronegatividade da molécula;
- Dipolo Induzido: Ocorre em moléculas apolares que são induzidas a uma distribuição desigual de elétrons pela aproximação de algum outro dipolo;
- Dipolo instantâneo: Ocorrem ao acaso, quando os elétrons concentram-se mais em uma região, produzindo uma diferença de eletronegatividade temporária, a Forças de dispersão de London.
Força dipolo permanente[editar | editar código-fonte]
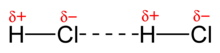
A força dipolo permanente, também chamada de Forças de Keesom em homenagem a Willem Hendrik Keesom, quem primeiro descreveu matematicamente a força em 1921, ocorre em moléculas polares, como, por exemplo, na molécula de HCl, em haletos de alquila e cetona.
Na molécula polar, na parte mais eletronegativa forma-se um dipolo elétrico permanente. Com a diferença de eletronegatividade, existe uma concentração de carga negativa no átomo mais eletronegativo deixando o átomo menos eletronegativo no lado positivo da molécula. Assim, a extremidade positiva de uma molécula atrai a extremidade negativa da outra molécula, e assim por diante, dando a interação.
Essas interações são fracas, sendo de cerca de 2 a 10 quilojoules por mol de interações, e variam de modo inversamente proporcional ao cubo da distância entre as moléculas, ou seja, se a distância entre as moléculas se multiplica por 10, a interação entre elas se divide por 1000.
Força dipolo induzido[editar | editar código-fonte]
A força dipolo induzido-dipolo induzido ou dipolo instantâneo-dipolo induzido é uma força de atração que aparece nas substâncias formadas por moléculas apolares, no estado sólido ou líquido.
A nuvem eletrônica nas moléculas apolares é uniforme, não aparecendo cargas.
Essa nuvem pode sofrer deformação por ação externa, como aumento de pressão e diminuição de temperatura, provocando, então, uma distribuição desigual de cargas, o que faz com que surja um dipolo.
O dipolo instantâneo induz a polarização da molécula vizinha, resultando uma atração fraca entre elas.
Ver também[editar | editar código-fonte]
Referências
- ↑ Weast, Robert C. (1984). CRC Handbook of Chemistry and Physics (65th ed.). CRC Press. ISBN 0-8493-0465-2.
