Lactato desidrogenase

A lactato desidrogenase (LDH) é uma enzima (EC 1.1.1.27) que participa do processo de transformar a glicose em energia das células de animais, plantas e até de bactérias. Nos animais está presente nas células do fígado, coração, pâncreas, rins, músculos esqueléticos, cérebro e glóbulos vermelhos. Doenças que rompem essas células liberam LDH no sangue e podem ser detectados em exame de sangue, urina ou LCR. [1]
Tipos[editar | editar código-fonte]
Diferentes isoenzimas LDH são encontradas em diferentes órgãos. Assim um exame de isotipos permite ter uma ideia de quais células estão se rompendo. As áreas de maior concentração para cada tipo de isoenzima são[2]:
- LDH-1: Coração e glóbulos vermelhos
- LDH-2: Glóbulos brancos
- LDH-3: Pulmões
- LDH-4: Rins, placenta e pâncreas
- LDH-5: Fígado e músculo esquelético
LDH aumentada[editar | editar código-fonte]
Diversas doenças que lesionam células, como um infarto ou uma anemia hemolítica aumentam os valores de LDH, nesses casos os níveis de LDH 1 seriam superiores ao do LDH 2. Certos medicamentos e drogas podem aumentar o nível de LDH: Álcool, anestésicos, aspirina, fluoretos, mitramicina e procainamida. O exercício extenuante também pode aumentar os níveis de LDH.[2]
LDH diminuída[editar | editar código-fonte]
A vitamina C (ácido ascórbico) pode diminuir os níveis de LDH. Em raros casos os baixos níveis podem ser causados por mutações genéticas e acompanhados por cansaço e dor muscular mais rápido que o normal.[2]
Reações[editar | editar código-fonte]
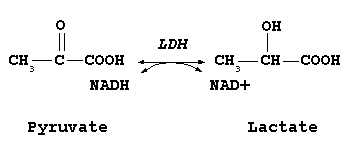
Catalisa a interconversão de piruvato e lactato com uma concomitante interconversão de NADH e NAD+. Converte o piruvato, o produto final da glicólise em lactato quando o oxigénio está ausente ou em pequenas quantidades, e realiza a reacção reversa durante o ciclo de Cori, via glicolítica anaeróbica, no fígado. A grandes concentrações de lactato, a enzima exibe inibição por feedback e a taxa de conversão do piruvato a lactato é reduzida. Em humanos, embora presente em praticamente todos os tecidos do corpo (em cinco diferentes isoformas), há quantidade muito mais elevada em células adaptáveis (mesmo que por curtíssimo período de tempo) à via anaeróbica, como os diferentes miócitos, ou que dela dependem, como os eritrócitos. Sua elevação pode ser dosada durante dano tecidual inespecífico (LDH-Total). Se comprovada, solicita-se dosagem de suas isoformas no auxílio de qual órgão está a ser afetado, acordando para o fato de maior quantidade de LDH-1 estar presente na mm cardíaca e eritrócitos, LDH-2 nos leucócitos e miócitos cardíacos, LDH-3 nos pneumócitos, LDH-4 nos rins, placenta e pâncreas e LDH-5 nos hepatócitos e miócitos esqueléticos.
Também catalisa a desidrogenação de 2-hidroxibutirato, mas é um substrato mais fraco que o lactato. Existe pouca ou nenhuma actividade com beta-hidroxibutirato.
Ver também[editar | editar código-fonte]
Referências
- ↑ https://labtestsonline.org/understanding/analytes/ldh/tab/test/
- ↑ a b c Judith Epstein e Natalie Butler RD (2015). What Are the Types of LDH Isoenzymes? http://www.healthline.com/health/lactate-dehydrogenase-test#Types2
