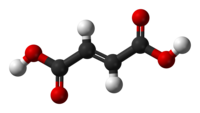
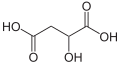
Ácido fumárico
O ácido fumáric está naturalmente presente em Corydalis, cogumelos e carne fresca. O produto precipitado da água é um pó cristalino ou cristalino branco monoclínico em forma de agulha, prismático ou semelhante a uma folha. É inodoro e tem um ácido especial e forte, cerca de 1,5 vezes maior que o do ácido cítrico. [4]
O ácido fumárico é um ácido dicarboxílico, insaturado, de cadeia normal, também conhecido como ácido donítico, que apresenta fórmula estrutural:
- * Fórmula molecular: C4H4O4
- * Massa molecular: 116 u
Obtenção[editar | editar código-fonte]
O ácido fumárico e seu isômero, ácido maleico, são obtidos pela decomposição [Nota 1] do ácido málico, a 180°C.[Nota 2][1]
-
Ácido málico
-
Ácido maleico
Propriedades[editar | editar código-fonte]
Este artigo não cita fontes confiáveis. (Junho de 2013) |
Físicas[editar | editar código-fonte]
- Sólido cristalino incolor.
- É mais estável que a forma cis - ácido maleico - apresentando, portanto, ponto de fusão e densidade maior.
- Faz ligações de hidrogênio intermoleculares, enquanto que o ácido maleico faz ligações de hidrogênio intramoleculares.
Químicas[editar | editar código-fonte]
O mecanismo da reacção de isomerização do ácido maleico é um mecanismo relativamente simples: a ligação dupla é uma ligação muito rígida, não permitindo, por isso, a rotação dos átomos de carbono da ligação dupla.
Ao adicionar ácido clorídrico (constante de ionização muito elevada), há uma grande quantidade de ions H+ livres que se podem ligar aos átomos de carbono do ácido maleico, ligação essa que se forma com recurso a um dos pares electrónicos da ligação dupla C=C, tornando-a uma ligação simples (formação de um aducto). Essa ligação é pouco rígida e permite a rotação dos átomos de carbono. Havendo a possibilidade de rotação, os pares ácidos da molécula tendem a afastar-se de maneira a diminuir as forças de repulsão electrónica, situando-se nos extremos opostos (isomeria trans). Ao dar-se a transição, a molécula liberta os átomos de H+, deslocando-se no sentido da formação do ácido fumárico, de maneira a tornar-se mais estável.
Assim, o ácido maleico é um isómero cis, sendo, tendencialmente, menos estável que o correspondente isómero trans, o ácido fumárico. Logo, e devido à menor estabilidade da molécula cis, o seu ponto de fusão é muito menor (cerca de metade) do que o do ácido fumárico: suas moléculas passam da fase sólida à fase líquida (maior desorganização das moléculas) a uma energia/temperatura inferior, devido às ligações que formam entre si serem mais fracas.
Notas e referências
Notas
- ↑ A reação é uma desidratação, pois o ácido málico perde uma molécula de água.
- ↑ 350 graus Fahrenheit, no original.
Referências
- ↑ a b Society for the Diffusion of Useful Knowledge, Penny cyclopaedia, Volumes 13-14 (1839), Malic acid [google books]
- ↑ a b c Registo de CAS RN 110-17-8 na Base de Dados de Substâncias GESTIS do IFA, accessado em 3 de Junho de 2007.
- ↑ a b A. Reichert: Potentiometrische Titrationen in Theorie und Praxis.
- ↑ «Fumaric acid 110-17-8 wiki». GuideChem (em inglês). Consultado em 21 de setembro de 2023