Acoplamento de Hiyama
O acoplamento de Hiyama é uma reação de acoplamento cruzado catalisada por paládio entre organossilanos e haletos orgânicos. Essa reação foi descoberta em 1988 por Tamejiro Hiyama e Yasuo Hatanaka como um método para formar ligações carbono-carbono sinteticamente com quimio e regiosseletividade.[1] O acoplamento de Hiyama tem sido aplicado à síntese de vários produtos naturais.[2]
- : aril, alquenil ou alquinil
- : aril, alquenil, alquinil ou alquil
- : Cl, F ou alquil
- : Cl, Br, I ou OTf (triflato)
Histórico[editar | editar código-fonte]
O acoplamento de Hiyama foi desenvolvido para contornar problemas associados a acoplamentos com outros reagentes organometálicos. A reatividade inicial do organossilicato não foi relatada pela primeira vez por Hiyama, mas por Kumada, que relatou uma reação de acoplamento usando organofluorosilicatos[3] mostrada abaixo. Hiyama, então, descobriu que organossilanos tornam-se reativos quando ativados por uma fonte de flúor.[4][5] Essa reatividade é catalisada por um composto contendo paládio, formando-se uma ligação carbono-carbono entre o carbono do organossilano e um carbono eletrofílico, como um haleto orgânico. Compostos de organossilício são inativos em comparação com reagentes organometálicos mais comuns, como organomagnésio (reagente de Grignard) e organocobre, que são muito reativos e pouco quimiosseletivos e podem destruir grupos funcionais em ambos os reagentes de acoplamento. Outros reagentes que utilizam metais como zinco (acoplamento de Negishi), estanho (acoplamento de Stille) e boro (acoplamento de Suzuki-Miyaura) são menos inadequados quanto à reatividade, mas apresentam outros problemas inerentes a cada um: os reagentes organozinco são sensíveis à umidade, os compostos organoestanho são tóxicos e os reagentes organoboro não costumam estar prontamente disponíveis, são caros e muitas vezes são instáveis. Os organosilanos são compostos mais acessíveis que, após a ativação, de modo semelhante ao dos compostos de organoestanho ou organoboro, com flúor ou uma base, podem reagir com organo-haletos para formar ligações C–C de maneira quimio e regiosseletiva. A reação relatada a princípio foi utilizada para acoplar e ativar facilmente nucleófilos de organossilício e organo-haletos (eletrófilos) na presença de um catalisador de paládio.[1] Desde essa descoberta, vários grupos têm trabalhado para expandir a abrangência dessa reação e remediar os problemas com esse primeiro acoplamento, como a necessidade de ativação do organossilano com flúor.
Mecanismo[editar | editar código-fonte]
O organossilano é ativado com flúor, geralmente com algum tipo de sal como TBAF — fluoreto de tetrabutilamônio — ou TASF — difluorotrimetilsilicato de tris(dimetilamino)sulfônio — ou com uma base para formar um centro de silício pentavalente lábil o suficiente para propiciar a quebra de uma ligação C–Si durante a etapa de transmetalação.[6] O esquema geral para formar essa chave intermediária é mostrado abaixo. Tal etapa ocorre in situ ou concomitantemente ao ciclo catalítico na reação.

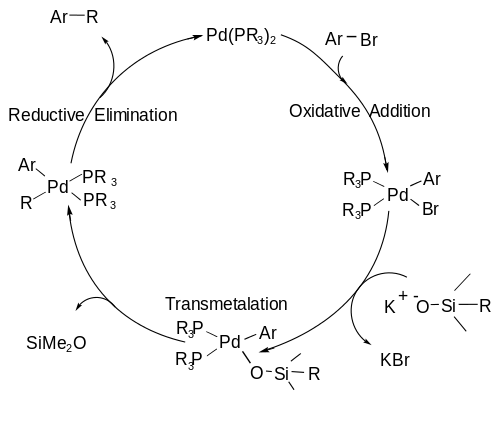
O mecanismo para o acoplamento de Hiyama segue um ciclo catalítico, incluindo: uma etapa de adição oxidativa (A), na qual o haleto orgânico se adiciona ao paládio oxidando o metal de paládio (0) para paládio (II); uma etapa de transmetalação (B), na qual a ligação C–Si é quebrada e o segundo fragmento de carbono é ligado ao centro de paládio; e, finalmente, uma etapa de eliminação redutiva (C), na qual a ligação C–C é formada e o paládio retorna ao seu estado de valência zero para reiniciar o ciclo.[7] O ciclo catalítico é mostrado abaixo.

Abrangência e limitações[editar | editar código-fonte]
Abrangência[editar | editar código-fonte]
O acoplamento de Hiyama pode ser aplicado à formação de ligações Csp2–Csp2 (por exemplo, aril–aril) e de ligações Csp2–Csp3 (por exemplo, aril–alquil). Bons rendimentos sintéticos são obtidos com acoplamentos de haletos de arila, haletos de vinila e haletos alílicos, sendo os maiores rendimentos proporcionados por compostos organoiodo. O escopo dessa reação foi expandido por Scott E. Denmark para incluir o fechamento de anéis de tamanho médio.[8]

O acoplamento de haletos de alquila com organo-halossilanos como alternativa a organossilanos também foi realizado. Os organoclorossilanos permitem acoplamentos com cloretos de arila, que são abundantes e geralmente mais econômicos que os iodetos de arila.[9] Um catalisador de níquel permite a reação de organotrifluorosilanos conforme relatado por GC Fu et al.[10] Com essa reação, haletos de alquila secundários são acoplados com arilsilanos[11] com bons rendimentos.

Limitações[editar | editar código-fonte]
O acoplamento Hiyama é limitado pela necessidade de flúor para ativar o reagente de organossilício. A adição de flúor cliva quaisquer grupos protetores de silício (por exemplo, éteres de silil)[12], que são freqüentemente empregados em síntese orgânica. O íon flúor também é básico, podendo sua adição afetar prótons ácidos e grupos protetores sensíveis a bases. A maior parte da pesquisa ativa sobre essa reação envolve o contorno desse problema. Para superá-lo, muitos grupos buscaram utilizar outros aditivos básicos para ativação ou encontrar um reagente organossilano diferente, o que levou a múltiplas variações do acoplamento Hiyama original.
Variações[editar | editar código-fonte]
Uma modificação do acoplamento de Hiyama utiliza um anel de silaciclobutano e uma fonte de flúor hidratada conforme mostrado abaixo.[13] Isso imita o uso de um alcoxisilano/organosilanol em vez do uso de alquilsilano. O mecanismo desta reação permitiu a projeção de reações futuras que possam evitar o uso da fonte de flúor.

Acoplamentos de Hiyama sem flúor[editar | editar código-fonte]
Muitas modificações ao acoplamento Hiyama foram desenvolvidas para evitar o uso de um ativador/base de flúor. Usando organoclorossilanos, Hiyama descobriu um esquema de acoplamento utilizando NaOH como ativador básico.[14] Modificações usando alcoxisilanos foram relatadas com o uso de bases mais suaves como NaOH[15] e até mesmo água.[16] O estudo desses mecanismos levou ao desenvolvimento do acoplamento Hiyama-Denmark, que utiliza organossilanóis como reagentes de acoplamento.

Outra classe de acoplamentos Hiyama sem flúor inclui o uso de um aditivo ácido de Lewis, que permite que bases como K3PO4[18] sejam utilizadas ou, até mesmo, que a reação ocorra sem um aditivo básico.[19][20] A adição de um cocatalisador de cobre também foi relatada para permitir o uso de um agente de ativação mais brando[18].

Acoplamento de Hiyama-Denmark[editar | editar código-fonte]
O acoplamento de Hiyama-Denmark é a modificação do acoplamento de Hiyama que não requer um aditivo de flúor para utilizar organossilanóis e haletos orgânicos como reagentes de acoplamento. No esquema geral da reação, mostrado abaixo, é utilizada uma base de Brønsted-Lowry como agente ativador em vez do flúor. Ligantes fosfina também estão presentes no centro metálico.[2]

Um exemplo dessa reação é mostradoa seguir. Se o flúor tivesse sido utilizado, como no protocolo original de Hiyama, o éter terc-butildimetilsilílico (TBDMS) provavelmente teria sido destruído.[21]

Mecanismo do acoplamento de Hiyama-Denmark[editar | editar código-fonte]
A análise do mecanismo dessa reação sugere que a formação do silonato é suficiente para proporcionar a adição do organossilano ao centro de paládio. A presença de um silício pentavalente não é necessária e a análise cinética mostrou que essa reação tem comportamento de primeira ordem em relação à concentração de silonato.[2] Isso se deve à formação da ligação chave, a ligação Pd–O durante a etapa de transmetalação, que permite a transferência do fragmento de carbono para o centro de paládio. Com base nessa observação, acredita-se que a etapa limitante da velocidade nesse ciclo catalítico é a formação da ligação Pd–O, na qual o aumento da concentração de silonato leva a um aumento da velocidade reacional (indicativo de que essa é a etapa lenta da reação).

Ligações externas[editar | editar código-fonte]
Ver também[editar | editar código-fonte]
- Acoplamento de Mizoroki-Heck
- Reação de Heck-Matsuda
- Acoplamento de Negishi
- Acoplamento de Sonogashira-Hagihara
- Acoplamento de Stille
- Acoplamento de Suzuki-Miyaura
- Acoplamento de Ullmann
Referências
- ↑ a b Hatanaka, Y.; Hiyama, T. (1988). «Cross-coupling of organosilanes with organic halides mediated by a palladium catalyst and tris(diethylamino)sulfonium difluorotrimethylsilicate». Journal of Organic Chemistry. 53 (4): 918–920. doi:10.1021/jo00239a056
- ↑ a b c Denmark, S. E.; Regens, C. S. (2008). «Palladium-Catalyzed Cross-Coupling Reactions of Organosilanols and Their Salts: Practical Alternatives to Boron- and Tin-Based Methods». Accounts of Chemical Research. 41 (11): 1486–1499. PMC 2648401
 . PMID 18681465. doi:10.1021/ar800037p
. PMID 18681465. doi:10.1021/ar800037p
- ↑ Yoshida, J.; Tamao, K.; Yamamoto, H.; Kakui, T.; Uchida, T.; Kumada, M. (1982). «Organofluorosilicates in organic synthesis. 14. Carbon-carbon bond formation promoted by palladium salts». Organometallics. 1 (3): 542–549. doi:10.1021/om00063a025
- ↑ Hiyama, T.; Obayashi, M.; Mori, I.; Nozaki, H. (1983). «Generation of metal-free silyl anions from disilanes and fluoride catalyst. Synthetic reactions with aldehydes and 1,3-dienes». Journal of Organic Chemistry. 48 (6): 912–914. doi:10.1021/jo00154a043
- ↑ Fujita, M.; Hiyama, T. (1988). «Erythro-directive reduction of .alpha.-substituted alkanones by means of hydrosilanes in acidic media». Journal of Organic Chemistry. 53 (23): 5415–5421. doi:10.1021/jo00258a004
- ↑ Hiyama, T. (2002). «How I came across the silicon-based cross-coupling reaction». Journal of Organometallic Chemistry. 653 (1–2): 58–61. doi:10.1016/s0022-328x(02)01157-9
- ↑ Miyaura, N.; Suzuki, A. (1995). «Palladium-Catalyzed Cross-Coupling Reactions of Organoboron Compounds». Chemical Reviews. 95 (7): 2457–2483. doi:10.1021/cr00039a007
- ↑ a b Denmark, S. E.; Yang, S.-M. (2002). «Intramolecular Silicon-Assisted Cross-Coupling Reactions: General Synthesis of Medium-Sized Rings Containing a 1,3-cis-cis Diene Unit». Journal of the American Chemical Society. 124 (10): 2102–2103. PMID 11878949. doi:10.1021/ja0178158
- ↑ Gouda, K.-i.; Hagiwara, E.; Hatanaka, Y.; Hiyama, T. (1996). «Cross-Coupling Reactions of Aryl Chlorides with Organochlorosilanes: Highly Effective Methods for Arylation or Alkenylation of Aryl Chlorides». Journal of Organic Chemistry. 61 (21): 7232–7233. PMID 11667637. doi:10.1021/jo9611172
- ↑ Powell, D. A.; Fu, G. C. (2004). «Nickel-Catalyzed Cross-Couplings of Organosilicon Reagents with Unactivated Secondary Alkyl Bromides». Journal of the American Chemical Society. 126 (25): 7788–7789. PMID 15212521. doi:10.1021/ja047433c
- ↑ Strotman, N. A.; Sommer, S.; Fu, G. C. (2007). «Hiyama Reactions of Activated and Unactivated Secondary Alkyl Halides Catalyzed by a Nickel/Norephedrine Complex». Angewandte Chemie International Edition. 46 (19): 3556–3558. PMID 17444579. doi:10.1002/anie.200700440
- ↑ Greene, T. W.; Wuts, P. G. M. Protective Groups In Organic Synthesis, 3rd ed.; John Wiley & Sons: New York, 1991. ISBN 0471160199
- ↑ a b Denmark, S. E.; Wehrli, D.; Choi, J. Y. (2000). «Convergence of Mechanistic Pathways in the Palladium(0)-Catalyzed Cross-Coupling of Alkenylsilacyclobutanes and Alkenylsilanols». Organic Letters. 2 (16): 2491–2494. PMID 10956529. doi:10.1021/ol006170y
- ↑ Hagiwara, E.; Gouda, K.-i.; Hatanaka, Y.; Hiyama, T. (1997). «NaOH-Promoted cross-coupling reactions of organosilicon compounds with organic halides: Practical routes to biaryls, alkenylarenes and conjugated dienes». Tetrahedron Letters. 38 (3): 439–442. doi:10.1016/s0040-4039(96)02320-9
- ↑ Shi, S.; Zhang, Y. (2007). «Pd(OAc)2-Catalyzed Fluoride-Free Cross-Coupling Reactions of Arylsiloxanes with Aryl Bromides in Aqueous Medium». Journal of Organic Chemistry. 72 (15): 5927–5930. PMID 17585827. doi:10.1021/jo070855v
- ↑ Wolf, C.; Lerebours, R. (2004). «Palladium−Phosphinous Acid-Catalyzed NaOH-Promoted Cross-Coupling Reactions of Arylsiloxanes with Aryl Chlorides and Bromides in Water». Organic Letters. 6 (7): 1147–1150. PMID 15040744. doi:10.1021/ol049851s
- ↑ Hagiwara, E.; Gouda, K.-i.; Hatanaka, Y.; Hiyama, T. (1997). «NaOH-Promoted cross-coupling reactions of organosilicon compounds with organic halides: Practical routes to biaryls, alkenylarenes and conjugated dienes». Tetrahedron Letters. 38 (3): 439–442. doi:10.1016/s0040-4039(96)02320-9
- ↑ a b c Nakao, Y.; Takeda, M.; Matsumoto, T.; Hiyama, T. (2010). «Cross-Coupling Reactions through the Intramolecular Activation of Alkyl(triorgano)silanes». Angewandte Chemie. 122 (26): 4549–4552. Bibcode:2010AngCh.122.4549N. doi:10.1002/ange.201000816
- ↑ Hirabayashi, K.; Mori, A.; Kawashima, J.; Suguro, M.; Nishihara, Y.; Hiyama, T. (2000). «Palladium-Catalyzed Cross-Coupling of Silanols, Silanediols, and Silanetriols Promoted by Silver(I) Oxide». Journal of Organic Chemistry. 65 (17): 5342–5349. PMID 10993364. doi:10.1021/jo000679p
- ↑ Nishihara, Y.; Ikegashira, K.; Hirabayashi, K.; Ando, J.-i.; Mori, A.; Hiyama, T. (2000). «Coupling Reactions of Alkynylsilanes Mediated by a Cu(I) Salt: Novel Syntheses of Conjugate Diynes and Disubstituted Ethynes». Journal of Organic Chemistry. 65 (6): 1780–1787. PMID 10814151. doi:10.1021/jo991686k
- ↑ a b Denmark, S. E.; Smith, R. C.; Chang, W.-T. T.; Muhuhi, J. M. (2009). «Cross-Coupling Reactions of Aromatic and Heteroaromatic Silanolates with Aromatic and Heteroaromatic Halides». Journal of the American Chemical Society. 131 (8): 3104–3118. PMC 2765516
 . PMID 19199785. doi:10.1021/ja8091449
. PMID 19199785. doi:10.1021/ja8091449

![The General Scheme for the Hiyama Coupling {\displaystyle {\begin{matrix}{}\\{\ce {{R-SiR''_{3}}+R'-X->[\mathrm {F^{-}} ][{\text{Pd cat.}}]R-R'}}\end{matrix}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/45686837800f1a0e625c8ab13b8224dd6e26a10e)



