Acoplamento de Ullmann
A reação de Ullmann ou acoplamento de Ullmann é uma reação de acoplamento entre haletos de arila. Tradicionalmente, ela é realizada sob catálise por cobre, mas paládio e níquel também são catalisadores eficazes.[1][2] A reação recebeu o nome de Fritz Ullmann.[3]

Mecanismo[editar | editar código-fonte]
O mecanismo da reação do tipo Ullmann é extensivamente estudado. Complicações surgem porque as reações costumam ser heterogêneas. Com o cobre como receptor de haleto, considera-se que intermediários organocobre são formados.
Abrangência e mecanismo[editar | editar código-fonte]
Um exemplo típico de acoplamento bisarílico clássico de Ullmann é a conversão de orto-cloronitrobenzeno em 2,2'-dinitrobifenilo com uma liga cobre-bronze.[4][5]

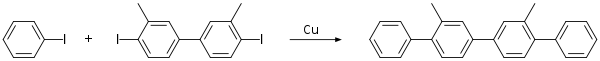
A versão tradicional da reação de Ullmann requer condições reacionais severas e a reação tem uma reputação de rendimentos erráticos. Devido a esses problemas, muitas melhorias e procedimentos alternativos foram introduzidos.[6][7]
A reação de Ullmann clássica é limitada a haletos de arila deficientes em elétrons e requer condições de reação extremas. Variantes modernas da reação de Ullman empregando paládio e níquel ampliaram o escopo do substrato da reação e tornaram as condições reacionais mais suaves. No entanto, os rendimentos geralmente ainda são moderados.[2] Na síntese orgânica, essa reação é frequentemente substituída por reações de acoplamento com paládio, como a reação de Heck, o acoplamento de Hiyama e o acoplamento de Sonogashira.
Já foram obtidos bifenilos com rendimentos razoáveis usando 2,2-di-iodobifenil ou o íon 2,2-di-iodobifenilônio como material de partida.
O fechamento de anéis de 5 membros é mais fácil, mas anéis maiores também foram feitos por meio dessa abordagem.
A ressonância eletrônica de spin descarta um intermediário radicalar no mecanismo da reação de Ullmann. A sequência adição oxidativa/eliminação redutiva observada com catalisadores de paládio é improvável para o cobre porque o cobre(III) raramente é observado. A reação provavelmente envolve a formação de um composto organocobre (RCuX) que reage com o outro reagente aril em uma substituição aromática nucleofílica. Existem mecanismos alternativos, como metátese de ligação σ.[8]
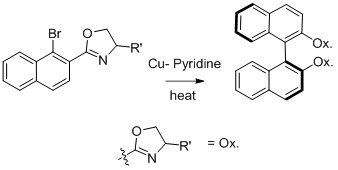
Acoplamentos assimétricos[editar | editar código-fonte]
A síntese de Ullmann de compostos biarílicos pode ser usada para gerar produtos quirais a partir de reagentes quirais.[9] Nelson e colaboradores trabalharam na síntese de compostos biarílicos assimétricos e obtiveram o produto controlado termodinamicamente.[9]
A proporção diastereomérica dos produtos é aumentada com substituintes R mais volumosos no grupo auxiliar de oxazolina.
As reações de Ullmann assimétricas raramente são realizadas, mas foram alcançadas quando um dos dois componentes de acoplamento está em excesso.[7]
Reação Ullmann do Imidazol[editar | editar código-fonte]
Em uma variação da reação de Ullmann, reage-se o β-bromoestireno com imidazol em um líquido iônico tal como tetrafluoroborato de 1-butil-3-metilimidazólio para dar um N -estirilimidazol.[10] A reação requer L-prolina, além de iodeto de cobre (I) como catalisador.

Ver também[editar | editar código-fonte]
- Acoplamento de Heck-Matsuda
- Acoplamento de Sonogashira-Hagihara
- Acomplamento de Stille
- Acoplamento de Negishi
- Acoplamento de Suzuki-Miyaura
Referências
- ↑ Yin; Liebscher, Jürgen (2007). «Carbon−Carbon Coupling Reactions Catalyzed by Heterogeneous Palladium Catalysts». Chemical Reviews. 107 (1): 133–173. PMID 17212474. doi:10.1021/cr0505674
- ↑ a b Nelson, T. D.; Crouch, R. D. (2004). «Cu, Ni, and Pd Mediated Homocoupling Reactions in Biaryl Syntheses: The Ullmann Reaction». Org. React. 63: 265. ISBN 0471264180. doi:10.1002/0471264180.or063.03
- ↑ F. Ullmann; Jean Bielecki (1901). «Ueber Synthesen in der Biphenylreihe». Chemische Berichte (em alemão). 34 (2): 2174–2185. doi:10.1002/cber.190103402141
- ↑ Reynold C. Fuson, E. A. Cleveland (1940). «2,2'-Dinitrobiphenyl». Org. Synth. 20: 45. doi:10.15227/orgsyn.020.0045
- ↑ Fanta, P.E. (1974). «The Ullmann Synthesis of Biaryls». Synthesis. 1974: 9–21. PMID 21016995. doi:10.1055/s-1974-23219
- ↑ Beletkaya, I.P.; Cheprakov, A.V. (2004). «Copper in Cross Coupling Reactions: The Post Ullman Chemistry». Coord. Chem. Rev. 248: 2337–2364. doi:10.1016/j.ccr.2004.09.014
- ↑ a b J. Hassan; M. Sevignon; C. Gozzi; E. Schulz; M. Lemaire (2002). «Aryl–Aryl Bond Formation One Century after the Discovery of the Ullmann Reaction». Chemical Reviews. 102 (5): 1359–1470. PMID 11996540. doi:10.1021/cr000664r
- ↑ Derek van Allen, PhD Thesis, University of Massachusetts at Amherst 2004. Electronic thesis
- ↑ a b Nelson, T.D.; Meyers, A.I. (1994). «The asymmetric Ullman reaction, 2. The synthesis of enantiomerically pure C2-Symmetric Binaphtyls». J. Org. Chem. 59 (9): 2655–2658. doi:10.1021/jo00088a066
- ↑ Zhiming Wang, Weiliang Bao and Yong Jiang, "L-Proline promoted Ullmann-type reaction of vinyl bromides with imidazoles in ionic liquids", Chemical Communications, 2005, 2849-51. doi:10.1039/b501628b