Hexafluoreto de selênio
| Hexafluoreto de selênio Alerta sobre risco à saúde | |
|---|---|
|
|
| Nome IUPAC | Hexafluoreto de selênio |
| Outros nomes | Fluoreto de selênio (VI), Fluoreto de selênio |
| Identificadores | |
| Número CAS | |
| PubChem | |
| ChemSpider | |
| Número RTECS | VS9450000 |
| SMILES |
|
| InChI | 1S/F6Se/c1-7(2,3,4,5)6
|
| Propriedades | |
| Fórmula molecular | SeF6 |
| Massa molar | 192.9534 g/mol |
| Aparência | gás incolor |
| Densidade | 0.007887 g/cm3[1] |
| Ponto de fusão |
-39 °C, 234 K, -38 °F |
| Ponto de ebulição |
-34.5 °C, 239 K, -30 °F |
| Solubilidade em água | insolúvel |
| Pressão de vapor | >1 atm (20°C)[2] |
| Susceptibilidade magnética | −51.0·10−6 cm3/mol |
| Índice de refracção (nD) | 1.895 |
| Estrutura | |
| Estrutura cristalina | Ortorrômbico, oP28 |
| Grupo de espaço | Pnma, No. 62 |
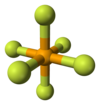
| Geometria de coordenação |
octaedral (Oh) |
| Momento dipolar | 0 |
| Termoquímica | |
| Entalpia padrão de formação ΔfH |
1030 kJ/mol[3] |
| Riscos associados | |
| Principais riscos associados |
tóxico, corrosivo |
| NFPA 704 | |
| EUA Limite de exposição permissível (PEL) |
TWA 0.05 ppm (0.4 mg/m3)[2] |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
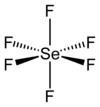
O hexafluoreto de selênio é o composto inorgânico com a fórmula SeF6 . É um gás incolor muito tóxico descrito como tendo um "odor repulsivo".[4] Não é amplamente encontrado e não possui aplicações comerciais.
Estrutura, preparação e reações
[editar | editar código-fonte]Como muitos compostos de selênio, o SeF6 é hipervalente. O composto possui geometria molecular octaédrica com um comprimento de ligação Se−F de 168,8 pm.
O SeF6 pode ser preparado a partir dos elementos[5] ou pela reação do trifluoreto de bromo (BrF3) com dióxido de selênio. O produto bruto é purificado por sublimação.
A reatividade relativa dos hexafluoretos de S, Se e Te segue a ordem TeF6 > SeF6 > SF6, sendo este último completamente inerte à hidrólise até altas temperaturas. O SeF6 também é resiste à hidrólise. O gás pode ser passado através de NaOH ou KOH a 10% sem alteração, mas reage com amônia gasosa a 200 °C.[6]
Segurança
[editar | editar código-fonte]Embora o hexafluoreto de selênio seja bastante inerte e demore a hidrolisar, é tóxico mesmo em baixas concentrações,[7] principalmente por uma exposição mais longa. Nos EUA, os padrões da OSHA e da ACGIH para exposição ao hexafluoreto de selênio são de um limite superior de em média 0,05 ppm no ar em um turno de trabalho de oito horas. Além disso, o hexafluoreto de selênio é designado como produto químico IDLH com um limite máximo de exposição permitido de 2 ppm.[8]
Referências
- ↑ Lide, D. R., ed. (2005). CRC Handbook of Chemistry and Physics 86th ed. Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5
- ↑ a b NIOSH Pocket Guide to Chemical Hazards. «#0551» (em inglês). National Institute for Occupational Safety and Health (NIOSH)
- ↑ Wiberg, E.; Holleman, A. F. (2001). Inorganic Chemistry. [S.l.]: Elsevier. ISBN 0-12-352651-5
- ↑ «Material Safety» (PDF)
- ↑ «Sulfur, Selenium, and Tellurium Hexafluorides». Inorganic Syntheses. 1: 121–122. 1939. doi:10.1002/9780470132326.ch44
- ↑ Bonmann, S. (1994). King, R. B., ed. Encyclopedia of Inorganic Chemistry. John Wiley & Sons. ISBN 0-471-93620-0
- ↑ «Medical Management Guidelines for Selenium Hexafluoride (SeF6)». CDC ATSDR
- ↑ Documentation for Immediately Dangerous To Life or Health Concentrations (IDLHs)

