Fosfol
| Fosfol Alerta sobre risco à saúde | |
|---|---|

|
|
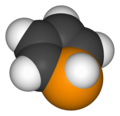
| Nome IUPAC | 1H-Fosfol |
| Identificadores | |
| Número CAS | |
| PubChem | |
| ChemSpider | |
| SMILES |
|
| InChI | InChI=1S/C4H5P/c1-2-4-5-3-1/h1-5H
|
| Propriedades | |
| Fórmula química | C4H5P |
| Massa molar | 84.06 g mol-1 |
| Compostos relacionados | |
| Compostos heterocíclicos relacionados | Fosforina (hexagonal) Pirrol (com NH em vez do PH) Arsol (com AsH em vez do PH) Tiofeno (com S em vez do PH) |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
Fosfol é o composto de fórmula C4H4PH; é o análogo de fósforo do pirrol. O termo fosfol também refere a derivados substituídos do heterociclo. Esses compostos são de interesse teórico e também servem como ligantes para metais de transição e como precursores de compostos organofosforosos mais complexos.
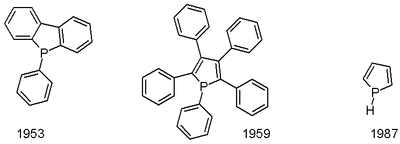
O primeiro fosfol, pentafenilfosfol, foi relatado em 1953, e o fosfol propriamente dito foi primeiro descrito em em 1987.[1] Fosfóis são normalmente produzidos via reação de McCormack, envolvendo a adição de um 1,3-dieno ao cloreto fosfonoso seguida por deidroalogenação.[2] Fenilfosfóis são preparados via zirconaciclopentadienos em reação com PhPCl2.[3]
Diferente dos heterociclos pentacarbônicos pirrol, tiofeno e furano, a aromaticidade dos fosfóis é menor, refletindo a relutância do fósforo em deslocar seu par de elétrons.[4] Por exemplo, fosfóis sofrem reação de Diels-Alder com alcinos eletrófilos.
Reatividade[editar | editar código-fonte]
A química do fosfol é limitada devido à sua sensibilidade à umidade 2,5-difenil-fosfóis podem ser funcionalizados por deprotonação seguida de P-acilação, produzindo então um equilíbrio 1H, 2H, 3H de fosfoletos, resultando em deslocamento 1:3 do grupo acila. [5] Fosfóis podem ser transformados em fosfobenzenos β-funcionais (fosfininas, ou fosforina) via funcionalização por cloreto de imidoíla e inserção.[6]
Ver também[editar | editar código-fonte]
Referências[editar | editar código-fonte]
- ↑ A Guide to Organophosphorus Chemistry Louis D. Quin 2000 John Wiley & Sons ISBN 0-471-31824-8
- ↑ W. B. McCormack (1973). «3-Methyl-1-Phenylphospholene oxide». Org. Synth.; Coll. Vol., 5
- ↑ Paul J. Fagan and William A. Nugent (1998). «1-Phenyl-2,3,4,5-Tetramethylphosphole». Org. Synth.; Coll. Vol., 9
- ↑ D. B. Chesnut, L. D. Quin (2007). «The important role of the phosphorus lone pair in phosphole aromaticity». Heteroatom Chemistry. 18. 754 páginas. doi:10.1002/hc.20364
- ↑ Magali Clochard, Joanna Grundy, Bruno Donnadieu, and François Mathey (2005). «A straightforward synthesis of 3-acylphospholes.». Organic Letters. 7 (20): 4511–4513. PMID 16178571. doi:10.1021/ol051816d
- ↑ Grundy, J. and Mathey, F. (2005). «One-Pot Conversion of Phospholide Ions into β-Functional Phosphinines». Angewandte Chemie International Edition. 44: 1082–1084. doi:10.1002/anie.200462020