Intermediários tetraédricos
Um intermediário tetraédrico pode ser definido como um intermediário reativo formado a partir de uma adição nucleofílica ao átomo de carbono de uma carbonila, o que faz com que o carbono que estava arranjado inicialmente numa geometria trigonal plana (hibridização sp²) adquira uma geometria tetraédrica (hibridização sp3). A estabilidade do intermediário tetraédrico está relacionada diretamente à capacidade dos grupos ligados ao átomo de carbono tetraédrico em dispersar a carga negativa. A formação de intermediários tetraédricos pode ser observada numa grande gama de reações em síntese orgânica e sistema biológicos, como, por exemplo, transesterificação, esterificação, hidrólise de ésteres, amida e pepitídeos.[1][2]
História[editar | editar código-fonte]
Um dos primeiros relatos acerca de intermediários tetraédricos foi feito em 1887 por Rainer Ludwig Claisen, um químico alemão conhecido por seus trabalhos sobre condensação de carbonilas e rearranjos sigmatrópicos. Claisen discorreu sobre as transformações envolvendo a reação de ésteres com nucleófilos, onde ao reagir-se o benzoato de benzila com o metóxido de sódio, e o benzoato metila com o benzilóxido de sódio, foi possível observar a formação de um precipitado branco, que após um tratamento ácido forneceu os mesmos produtos, benzoato de benzila, benzoato de metila, metanol e álcool benzílico (representação abaixo). Diante disto, Claisen chamou o provável intermediário reacional de “additionelle Verbindung”, que em livre tradução significa composto de adição ou aduto.[1][3]

Um pouco mais tarde, em 1901, o químico francês François Auguste Victor Grignard reagindo seus notáveis compostos organometálicos à base de magnésio com ésteres, obteve um alcoolato metálico terciário, o que o fez assumir a existência de um instável intermediário tetraédrico, como representado a baixo.[1][4]
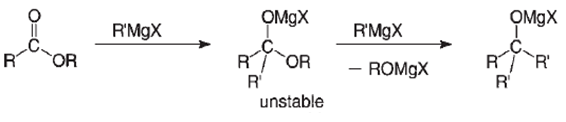
Contudo, somente em 1951 o químico norte americano Myron Lee Bender, em seu trabalho intitulado “Oxygen Exchange as Evidence for the Existence of an Intermediate in Ester Hydrolysis” obteve a primeira evidência da formação de intermediários tetraédricos em reações de substituição nucleofílica de derivados caboxilados. Através da marcação isotópica da carbonila do benzoato de etila, benzoato de propila e benzoato de t-butila com 18O, foi possível, através do acompanhamento da cinética de hidrólise destes ésteres e o acompanhamento da mudança do 18O, verificar que os valores das constantes de velocidade eram similares, sugerindo um mesmo mecanismo de hidrólise. Além disso, foi possível verificar que em todos os casos ocorria a troca do oxigênio da carbonila do éster e o solvente (água), constituindo uma evidência da formação do intermediário tetraédrico.[1][5]
Mecanismo[editar | editar código-fonte]
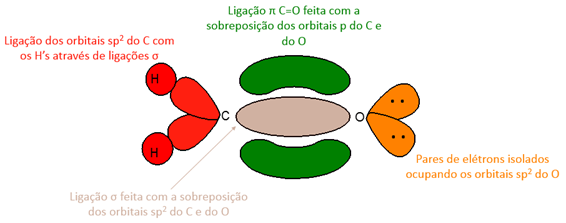
A dupla ligação carbono oxigênio, como a observada em carbonilas, é composta basicamente por duas partes complementares, uma relacionada à ligação σ e outra relacionada à ligação π. Na ligação σ realizada entre o carbono e o oxigênio, ambos os átomos estão hibridizados na forma sp². Os orbitais sp² remanescentes do carbono estão ligados, através de ligações σ, a outros dois substituintes e a formação da ligação π ocorre através da sobreposição dos orbitais p remanescentes na molécula, isto faz com que a mesma se organize espacialmente numa geometria trigonal plana (representação abaixo). Os orbitais sp² do oxigênio são responsáveis por comportar os pares de elétrons isolados.[1][6]
Devido à elevada eletronegatividade do oxigênio, a ligação C=O é polarizada, isto faz com que haja uma distorção da nuvem eletrônica em direção ao oxigênio. Consequentemente, o orbital π* antiligante não preenchido do oxigênio é inclinado no sentido oposto. A polarização da ligação C=O atribui ao carbono uma carga parcial positiva, sendo esta a responsável por atrair um nucleófilo e “encorajar” a reação. Neste aspecto, a polarização do orbital π* antiligante é igualmente importante, pois num ataque nucleofílico à carbonila os elétrons movem-se do HOMO do nucleófilo em direção ao LUMO do eletrófilo, neste caso o orbital π* antiligante. Como é possível ver na representação abaixo, a medida que o nucleófilo se aproxima do átomo de carbono, os pares de elétrons presentes no HOMO do nucleófilo começam a interagir com o LUMO (π* antiligante) da carbonila para formar uma nova ligação σ, o que provoca a quebra da ligação π e promove a “migração” dos elétrons para o oxigênio, atribuindo assim uma carga negativa ao mesmo. Desse modo, a adição do nucleófilo à carbonila, além da formação de uma nova ligação, também promove a mudança de hibridização do carbono de sp² para sp3, alterando assim a geometria do intermediário de trigonal plana para tetraédrica.[1][6]
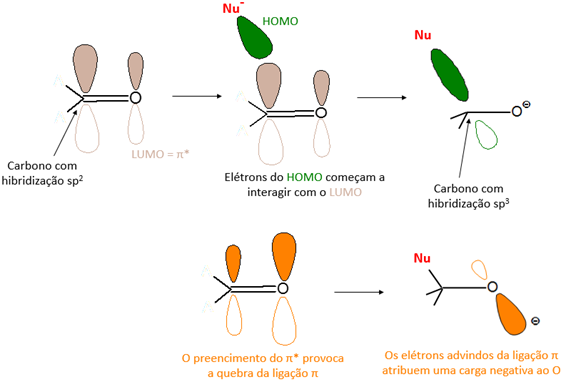
A aproximação e ataque do nucleófilo à carbonila ocorre através de um ângulo específfico, cujo direcionamento é conhecido como trajetória de Bürgi-Dunitz. Neste caso, ao invés de uma aproximação perpendicular ao plano da molécula, o nucleófilo descreve uma trajetória de aproximação num ângulo próximo à 107° em relação à carbonila, muito próximo ao àngulo no qual a nova ligação σ será formada. Esta trajetória é justificada pela necessidade de uma maximização da sobreposição do HOMO do nucleófilo com o LUMO da carbonila, bem como a minimização da repulsão eletrônica do HOMO com a densidade eletrônica da ligação π (representação abaixo).[1][6]

Redução de amidas por boranos[editar | editar código-fonte]
A seqüência das etapas de redução de amidas por boranos depende da estrutura das amidas. Da mesma forma verificada para redutores nucleofílicos, a reação de amidas com redutores eletrofílicos passa também por um intermediário tetraédrico, exceto em situações em que a energia de dissociação do redutor na forma dimérica é maior. A formação do intermediário tetraédrico ocorre em duas etapas, apresentando inicialmente a ativação do oxigênio e, posteriormente o ataque por hidreto ao carbono do grupo amido (conforme esquema reacional abaixo).[7]

Acetais e Hemiacetais[editar | editar código-fonte]
Acetais e hemiacetais são espécies extremamente interessantes, pois apesar de serem relativamente estáveis e muitas vezes utilizados como grupos protetores em sínteses orgânicas (acetais), estes são essencialmente intermediários tetraédricos formados a partir de um ataque nucleofílico à uma carbonila. Na presença de um ácido, os hemiacetais podem ser submetidos a uma reação de eliminação, perdendo assim o átomo de oxigênio advindo da carbonila do aldeído precursor. Como representado no esquema a seguir, íon oxônio formado a partir da protonação da carbonila é um forte eletrófilo, o que propicia uma rápida reação com uma molécula de álcool e por conseguinte a geração de um aduto, que ao ser desprotonado dá origem à um hemiacetal. Após eliminar uma molécula de água e ter novamente o íon oxônio atacado por outra molécula do álcool, após a desprotonação, é obtido um acetal.[1][8]

Transesterificação e esterificação (produção de biodiesel)[editar | editar código-fonte]
Uma das formas mais comuns de se produzir biodiesel, principalmente em ambiente industrial, é através da transesterificação de óleos vegetais e gorduras animais. Na transesterificação alcalina, os triacilgliceróis presentes neste tipo de matéria prima (> 98%m/m) reagem com um álcool de cadeia curta (geralmente o metanol) na presença de um catalisador homogêneo alcalino (geralmente metóxido de sódio ou potássio), produzindo uma mistura de ésteres (biodiesel) e glicerina.[9][10]

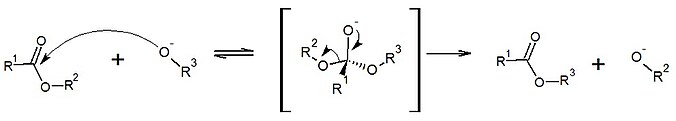
O mecanismo mais aceito para esta reação tem como base um ataque nucleofílico do alcóxido (catalisador) a uma das carbonilas do triacilglicerol, desse modo é formado um intermediário tetraédrico que tende a sofrer um rearranjo, liberando assim um monoéster, um diacilglicerol e outro alcóxido. Desse modo, o alcóxido formado é responsável agora por atacar o diacilglicerol formado e continuar o ciclo (esquema reacional a seguir mostra a transesterificação alcalina de um monoéster).[9][10]
Apesar de não ser a principal rota de produção industrial, a transesterificação por via ácida também pode ser empregada na produção de biodiesel. Neste aspecto, o mecanismo mais aceito para a reação inicia-se com a protonação de uma das carbonilas do triacilglicerol, o que promove a formação de um carbocátion que em seguida sofre um ataque nucleofílico pela molécula do álcool de cadeia curta, formando assim um intermediário tetraédrico que tende a se rearranjar liberando para o sistema um monoéster, um diacilglicerol e um H+, sendo este último o responsável por atacar uma carbonila do diacilglicerol formado e continuar o ciclo (esquema reacional a seguir mostra a transesterificação ácida de um monoéster).[9][10]

Outra forma conhecida de produção de biodiesel (principalmente em matérias primas de alta acidez) é a esterificação de óleos vegetais e gorduras animais. Um fato interessante, é que muitas vezes a esterificação pode funcionar como uma etapa de pré-tratamento, objetivando a redução da acidez da matéria prima (causa principalmente pelos ácidos graxos livres, geralmente gerados pela hidrólise do triacilglicerol) e colocando-a em níveis aceitáveis para a transesterificação por via alcalina. O mecanimso mais aceito para a esterificação é semelhante ao observado para a transesterificação por via ácida, contudo ocorre preferencialmente a protonação das carbonilas dos ácidos graxos livres, que em seguida são nucleofilicamente atacados pela molécula do álcool de cadeia curta formando assim o intermediário tetraédrico. Após a eliminação de uma molécula de água e um rearranjo da estrutura é gerado o monoéster (esquema reacional a seguir).[9][11]

Referências
- ↑ a b c d e f g h Adler, Martin; Sandra (1 de março de 2005). «Tetrahedral intermediates in reactions of carboxylic acid derivatives with nucleophiles». Journal of Physical Organic Chemistry (em inglês). 18 (3): 193-209. ISSN 1099-1395. doi:10.1002/poc.807
- ↑ «IUPAC GOLD BOOK - Tetrahedral Intermediate»
- ↑ Claisen, L. (1 de janeiro de 1887). «Ueber die Einwirkung von Natriumalkylaten auf Benzaldehyd». Berichte der deutschen chemischen Gesellschaft (em inglês). 20 (1): 646-650. ISSN 1099-0682. doi:10.1002/cber.188702001148
- ↑ Grignard, V. «Mixed organomagnesium combinations and their application in acid, alcohol, and hydrocarbon synthesis». Ann. Chim. Phys.
- ↑ Bender, Myron L. (1 de maio de 2002). «Oxygen Exchange as Evidence for the Existence of an Intermediate in Ester Hydrolysis». Journal of the American Chemical Society (em inglês). 73 (4): 1626-1629. doi:10.1021/ja01148a063
- ↑ a b c «NUCLEOPHILIC ADDITION TO THE CARBONYL GROUP - Universidade Eslovaca de Tecnologia» (PDF)
- ↑ Alcântara, Antônio Flávio de Carvalho; Hiléia dos Santos. «Redução de amidas por boranos». Química Nova. 25 (2): 300-311. ISSN 0100-4042. doi:10.1590/S0100-40422002000200018
- ↑ Kautz, Jacqueline; Willian. «CONDENSATION REACTION OF GLYCEROL AND CARBONYL COMPOUNDS: SYNTHESIS, CHARACTERIZATION, AND DERIVATIZATION FOR LIQUID CRYSTALS». Química Nova. doi:10.5935/0100-4042.20150111
- ↑ a b c d Cordeiro, Claudiney Soares; Fabiano Rosa da. «Catalisadores heterogêneos para a produção de monoésteres graxos (biodiesel)». Química Nova. 34 (3): 477-486. ISSN 0100-4042. doi:10.1590/S0100-40422011000300021
- ↑ a b c Meneghetti, S. M. P.; M. R. «Transesterification, Some Applications and Biodiesel Production». Revista Virtual de Química. 5 (1). doi:10.5935/1984-6835.20130007
- ↑ Moraes Calvalcante, Phelipe Matheus; Renato Luiz da. «Proposta de preparação e caracterização de ésteres: um experimento de análise orgânica na graduação». Educación Química. 26 (4): 319-329. doi:10.1016/j.eq.2015.07.003
