Luminol
Este artigo ou secção contém uma lista de referências no fim do texto, mas as suas fontes não são claras porque não são citadas no corpo do artigo, o que compromete a confiabilidade das informações. (Maio de 2022) |
| Luminol Alerta sobre risco à saúde | |
|---|---|
| |
| |
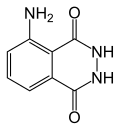
| Nome IUPAC | 5-Amino-2,3-dihydro- 1,4-phthalazinedione |
| Identificadores | |
| Número CAS | |
| Propriedades | |
| Fórmula molecular | C8H7N3O2 |
| Massa molar | 177.16 g/mol |
| Ponto de fusão |
319-320 °C |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
Luminol é uma substância química criada em 1928 por H. O. Albrecht, durante seu trabalho de doutoramento. Posteriormente, Fritz Feigl e seus colaboradores reconheceram o potencial desse reagente, na área da técnica de análise de toque, para a identificação de diminutas quantidades de peróxidos e íons ferricianeto. O bonito efeito luminescente, obtido como resultado, fez com que essa reação fosse logo apresentada em demonstrações para a divulgação da Química, peças teatrais e eventos artísticos. Com aplicações mais práticas, trata-se de um produto que é preparado misturando-se o Luminol propriamente dito, com uma substância à base de peróxido de hidrogênio (água oxigenada), que reage muito lentamente. Quando essa mistura entra em contato com o sangue humano, utiliza o ferro presente na hemoglobina como agente catalisador causando uma reação de químioluminescência.

Muito utilizado pela polícia científica, quando necessita saber se há vestígios de sangue em roupas, objetos ou lugares. No caso de tecidos, mesmo que a cena do crime tenha sido limpa, as fibras do tecido absorvem partes do composto de ferro, e assim, quando aplicado o luminol, ele causa uma reação de oxidação e "ilumina", literalmente, o local, ficando uma cor azul fluorescente. É mais útil, quando usado junto com luz ultravioleta, podendo-se assim ver mais claramente as evidências de sangue por contornos bem definidos. É importante lembrar que a reação apenas identifica uma presença de possíveis vestígios de sangue, devendo se proceder a exames de DNA para identificações mais conclusivas quanto a identidades.
Reação química
[editar | editar código-fonte]O reagente principal, nesta reação, é o luminol (C8H7O2N3), um composto em pó. Os criminalistas misturam o pó de luminol com um líquido contendo peróxido de hidrogênio (H2O2), um meio alcalino e outros produtos químicos, despejando o líquido preparado por meio de um borrifador. O peróxido de hidrogênio e o luminol são os principais agentes da reação química, mas para que produzam um brilho forte, precisam de um catalisador para acelerar o processo. A mistura detecta a presença desse catalisador, no caso o ferro contido na hemoglobina.
Para executar um teste com luminol, os criminalistas pulverizam a mistura em qualquer lugar onde possa haver sangue. Se a hemoglobina e a mistura de luminol entram em contato, o ferro na hemoglobina acelera a reação entre o peróxido de hidrogênio e o luminol. Nesta reação de oxidação, o luminol perde átomos de nitrogênio e hidrogênio e adquire átomos de oxigênio, resultando em um composto denominado 3-aminoftalato. A reação deixa o 3-aminoftalato em um estado de energia mais elevado, pois os elétrons dos átomos de oxigênio são empurrados para orbitais superiores. Os elétrons retornam rapidamente para um nível de energia menor, emitindo a energia extra sob a forma de fótons de luz (veja Como funcionam as lâmpadas fluorescentes para mais informações sobre a produção de luz). Com o ferro acelerando o processo, a luz brilha o suficiente para ser vista em um ambiente escuro.
A otimização do conjunto de reações, que prepara o luminol em quantidades suficientes e com melhor custo e qualidade, para suprir as polícias técnicas, foi feita no Laboratório de Síntese e Análise de Produtos Estratégicos (Lasape) do Instituto de Química da UFRJ no Rio de Janeiro. Esta entidade é detentora de patentes no assunto.
Os detetives podem usar outros produtos químicos químioluminescentes, como a fluoresceína, no lugar do luminol. Estes produtos funcionam basicamente da mesma maneira, mas o procedimento é muito diferente.
Referências
[editar | editar código-fonte]- Albrecht, H. O. (1928) "Über die Chemiluminescenz des Aminophthalsäurehydrazids" (On the chemiluminescence of aminophthalic acid hydrazide)
Zeitschrift für Physikalische Chemie 136: 321-330.
- Shakhashiri, B. Z. In Chemical Demonstrations: A Handbook for Teachers of Chemistry;
The University of Wisconsin Press: 1985; Vol. 2, p 156-167.
