Peróxido de hidrogênio
| Fórmula estrutural | |
|---|---|
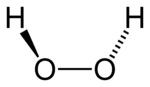
| |
| Geral | |
| Nome IUPAC | Peróxido de hidrogênio |
| Nomes usuais | Água oxigenada peróxido de di-hidrogênio dióxido de diidrogênio |
| Fórmula química | H2O2 |
| Massa molar | 34.01475 g/mol |
| Aparência | Líquido claro |
| Número do CAS | 7722-84-1 |
| Comportamento de fase | |
| Ponto de fusão | 262 K (-11°C) |
| Ponto de ebulição | 414 K (141°C) |
| Propriedades sólidas | |
| ΔfH0sol | -200 kJ kJ/mol |
| S0sol | ? J/mol·K |
| Propriedades líquidas | |
| Densidade | 1,476 g/cm³ |
| Solubilidade em água | miscível |
| Viscosidade | 1,245 cP a 20°C |
| ΔfH0liq | -188 kJ/mol |
| S0liq | 110 J/mol·K |
| Propriedades gasosas | |
| ΔfH0liq | -136,11 kJ/mol |
| S0liq | 232,95 J/mol·K |
| Segurança | |
| Símbolos de risco | |
 C Corrosivo | |
| Instruções de Risco e Segurança | R: 34 S: 3-26-36/37/39-45 |
| Ponto de fulgor | não inflamável |
| Ingestão | Problemas sérios, possível morte. |
| Inalação | Irritação severa. Possível morte. |
| Mais informações | |
| MSDS | Hazardous Chemical Database |
| Unidades do SI são usadas quando possível. Salvo quando especificado o contrário, são considerados condições normais de temperatura e pressão. | |
O peróxido de hidrogénio (português europeu) ou peróxido de hidrogênio (português brasileiro) que, em solução aquosa, é conhecido comercialmente como água oxigenada, é um líquido claro de fórmula química H2O2. Foi descrito a primeira vez por Louis Jacques Thénard, numa reacção de peróxido de bário com ácido nítrico.[1]
Trata-se de um líquido viscoso e poderoso oxidante. É incolor à temperatura ambiente e apresenta característico sabor amargo. Quantidades pequenas de peróxido de hidrogénio gasoso ocorrem naturalmente no ar. O peróxido de hidrogénio é instável e, quando perturbado, rapidamente se decompõe (através da enzima catalase, presente em nosso corpo), de H2O2, em água (H2O) e oxigênio (O2) com liberação de calor. Deste modo, quando ele é transformado em água e oxigénio pela catalase, acaba por matar bactérias e vírus anaeróbicos (que não sobrevivem à presença de oxigénio), pois libera oxigénio puro, tendo a função de desinfectante oxidante. Embora não seja inflamável, é poderoso agente oxidante que pode sofrer combustão espontânea em contacto com matéria orgânica, alguns metais como o cobre ou algumas ligas metálicas como o bronze.
O peróxido de hidrogénio actua ainda em diversos mecanismos de degradação de aminoácidos (em associação com amino-oxidases), por conta de seu poder oxidante elevado. Tal composto ainda pode actuar na fotossíntese (ciclo do glioxilato), e na síntese de glicose a partir de fontes que não contenham carboidratos (gliconeogénese).
Produção[editar | editar código-fonte]
Método antigo[editar | editar código-fonte]
O peróxido de hidrogênio costumava ser produzido a partir da eletrólise aquosa do a 50% em massa, produzindo o ácido peroxodissulfúrico e hidrogênio, segundo as semi-reações:
O ácido peroxodissulfúrico entra em equilíbrio químico com o ácido sulfúrico e o ácido peroxomonossulfúrico segundo a reação:
Por fim, o ácido peroxomonossulfúrico entra em equilíbrio químico com o ácido sulfúrico e o peróxido de hidrogênio:
Método moderno[editar | editar código-fonte]

O peróxido de hidrogênio é produzido industrialmente a partir do equilíbrio entre antraquinol e antraquinona na presença de oxigênio e hidrogênio. Ao final dessa etapa o peróxido de hidrogênio é extraído pela água e sua concentração é feita por meio da destilação a pressão reduzida. A água oxigenada vendida comercialmente, contudo, é uma mistura de água e peróxido de hidrogénio, sendo que o peróxido de hidrogénio representa entre 3% e 9% da mistura. Apesar de ser muitas vezes empregada dessa forma, "água oxigenada" não é sinónimo de "peróxido de hidrogênio".[carece de fontes]
Usos gerais[editar | editar código-fonte]
O peróxido de hidrogénio é encontrado em concentrações baixas (3-9%) em muitos produtos domésticos para uso medicinal e como clareador da roupa e do cabelo. Na indústria, o peróxido de hidrogénio é usado em concentrações mais elevadas para clarear tecidos, pasta de papel, e ainda como combustível para ajuste e correcção nas trajectórias e órbitas de satélites artificiais no espaço. Na área médica é usado como desinfectante ou agente esterilizante em autoclave de plasma. Na área química é usado como componente da espuma de borracha orgânica e outras substâncias químicas. Noutras áreas como na investigação é usado para medir a actividade de algumas enzimas como a catalase.
Pelo efeito desinfectante oxidante de sua catalase, o peróxido de hidrogénio é popularmente utilizado como antisséptico em feridas, mas estudos indicam que este uso é arriscado pelo potencial citotóxico da substância, que pode matar células saudáveis que auxiliariam no processo de cicatrização, causando mesmo embolismos em casos mais graves, havendo mortes confirmadas por uso hospitalar irresponsável.[2][3] Outros possíveis riscos à saúde associados ao peróxido de hidrogénio estão em sua ingestão (cuja hiperoxigenação pode causar acidentes vasculares cerebrais) e no dano a outras células do corpo em decorrência do efeito citotóxico já mencionado.[4]
Outros usos gerais do peróxido de hidrogénio incluem:
- clareamento de cabelos;
- monopropelente em motores de foguete e na propulsão de satélites;
- clareamento de carcaças de eletrônicos feitas em ABS (Retrobright)
- no tratamento da acne, com peróxido de benzoíla;
- no clareamento dental, na forma de peróxido de carbamida;
- na medicina veterinária;
- em processos de esterilização a baixa temperatura, na forma de plasma.
Referências
- ↑ L. J. Thénard (1818). «Observations sur des nouvelles combinaisons entre l'oxigène et divers acides». Annales de chimie et de physique, 2nd series. 8: 306–312
- ↑ Hamer, Ashley; Faletto, Joanie (15 de setembro de 2016). «You Should Stop Using Hydrogen Peroxide on Cuts». Curiosity.com. Consultado em 23 de janeiro de 2018
- ↑ Cina, S. J.; Downs, J. C.; Conradi, S. E. (março de 1994). «Hydrogen peroxide: a source of lethal oxygen embolism. Case report and review of the literature.». The American Journal of Forensic Medicine and Pathology. 15 (1): 44-50. Consultado em 23 de janeiro de 2018
- ↑ Watt, B. E.; Proudfoot, A. T.; Vale, J. A. (2004). «Hydrogen peroxide poisoning». Toxicological Reviews. 23 (1): 51-57. Consultado em 23 de janeiro de 2018








