Adição eletrofílica: diferenças entre revisões
m |
|||
| Linha 1: | Linha 1: | ||
{{mais notas|data=agosto de 2013}} |
{{mais notas|data=agosto de 2013}} |
||
Em [[química orgânica]], uma '''adição eletrofílica''' ou '''eletrófila''' ( |
Em [[química orgânica]], uma '''adição eletrofílica''' ou '''eletrófila''' (<math>A_Ex</math> ou <math>Ad_Ex</math>) é uma [[reação de adição]] onde em um [[composto químico]], o substrato da reação, se perde um [[ligação pi]] para permitir a formação de duas novas [[ligação sigma|ligações sigma]]. Nas reações de adição eletrofílica, os substratos mais comuns tem [[ligação dupla|ligações duplas]] ou [[ligação tripla|ligações triplas]] carbono-carbono.<ref>{{smallcaps|March}}, Jerry; (1985). Advanced Organic Chemistry reactions, mechanisms and structure (3rd ed.). New York: John Wiley & Sons, inc. ISBN 0-471-85472-7 </ref> |
||
[[Eletrófilo]]s são ácidos de Lewis, moléculas ou íons que pode aceitar um par de |
[[Eletrófilo]]s são ácidos de Lewis, moléculas ou íons que pode aceitar um par de [[elétron]]s. Qualquer reação de um eletrófilo também envolve um nucleófilo. O protonamento de um alceno, eletrófilo é o próton doado por um ácido, e o nucleófilo é o alceno. Estão inclusos reagentes positivos, tais como prótons, reagentes neutros, tais como bromo, e os [[Ácido de Lewis|ácidos de Lewis]] <math>BF_3</math> e <math>AlCl_3</math>.<ref>[http://www.infoescola.com/quimica/adicao-eletrofilica/ Adição Eletrofílica]</ref> |
||
==Reação de Halogenação== |
==Reação de Halogenação== |
||
R-H + X<sub>2</sub> => R-X + HX |
|||
| ⚫ | A halogenação de um alcano se dá por substituição de um átomo de hidrogênio por um halogênio, resultando em um haleto de alquila ( isso pode ocorrer em um ou mais átomos de hidrogênio ). Por exemplo, na cloração do metano e do etano os produtos são, respectivamente, cloro metano e cloro etano. Para alcanos com mais de dois carbonos existe mais de uma possibilidade para o halogênio se posicionar. Deste modo o produto da reação será uma mistura de isômeros de posição. Entretanto, as quantidades dos isômeros formados diferem-se na mistura. A reação ocorre via radicais livres. |
||
{{VT|Halogenação}} |
|||
| ⚫ | Tomemos como exemplo a bromação do propano. As quantidades de 1-bromopropano e 2-bromopropano obtidas dependem das velocidades relativas a que os radicais n-propial e isopropila se formam. Se os radicais isopropila se formarem mais rapidamente será também o 2-bromopropano o que se formará mais rapidamente e o que constitui, portanto, a maior parte dos produtos da reação. Devemos então comparar as |
||
<center> |
|||
:<math>R-H + X_2 \rightarrow R-X + HX</math> |
|||
</center> |
|||
| ⚫ | A halogenação de um alcano se dá por substituição de um átomo de [[hidrogênio]] por um [[halogênio]], resultando em um haleto de alquila ( isso pode ocorrer em um ou mais átomos de hidrogênio ). Por exemplo, na cloração do metano e do etano os produtos são, respectivamente, cloro metano e cloro etano. Para alcanos com mais de dois carbonos existe mais de uma possibilidade para o halogênio se posicionar. Deste modo o produto da reação será uma mistura de isômeros de posição. Entretanto, as quantidades dos isômeros formados diferem-se na mistura. A reação ocorre via radicais livres.<ref name=AdHH /> |
||
| ⚫ | Tomemos como exemplo a bromação do [[propano]]. As quantidades de 1-bromopropano e 2-bromopropano obtidas dependem das velocidades relativas a que os radicais n-propial e isopropila se formam. Se os radicais isopropila se formarem mais rapidamente será também o 2-[[bromopropano]] o que se formará mais rapidamente e o que constitui, portanto, a maior parte dos produtos da reação. Devemos então comparar as [[velocidade]]s relativas em que os hidrogênios primários e secundários são subtraídos do propano. A quantidade de cada composto será proporcional à seguinte ordem de facilidade com que o [[hidrogênio]] é liberado na [[molécula]]: |
||
[[File:Tharsila ordem de ligação pelos tipos de carbonos.jpg|Tharsila ordem de ligação pelos tipos de carbonos]] |
[[File:Tharsila ordem de ligação pelos tipos de carbonos.jpg|Tharsila ordem de ligação pelos tipos de carbonos]] |
||
| Linha 23: | Linha 28: | ||
A reação se divide em três etapas principais, a iniciação, propagação e a terminação. |
A reação se divide em três etapas principais, a iniciação, propagação e a terminação. |
||
A iniciação envolve a clivagem de uma molécula de cloro, pelo calor ou pela luz, em dois átomos de cloro. Na propagação, um átomo de cloro abstrai um de hidrogênio da molécula de metano, produzindo uma molécula de cloreto de hidrogênio (HCl) e um radical metila. Na etapa final, o radical metila, altamente reativo, reage com a molécula do cloro ( |
A iniciação envolve a clivagem de uma molécula de cloro, pelo calor ou pela luz, em dois átomos de cloro. Na propagação, um átomo de cloro abstrai um de hidrogênio da molécula de metano, produzindo uma molécula de cloreto de hidrogênio (<math>HCl</math>) e um radical [[metila]]. Na etapa final, o radical metila, altamente reativo, reage com a molécula do cloro (<math>Cl_2</math>) através da abstração de um [[átomo]] de [[cloro]]. Isso resulta na formação de uma molécula de clorometano e um átomo de cloro. Este último pode atacar uma outra [[molécula]] de [[metano]] e causar a repetição da etapa 2, depois da etapa 3... etapa 2, 3... centenas de vezes. Esse tipo de sequência é chamado de efeito em cadeia. A reação em cadeia pode ser encerrada por uma etapa conhecida como “terminação de cadeia”. |
||
==Adição via radicais livres por HBr== |
==Adição via radicais livres por HBr== |
||
A adição de brometo de hidrogênio a |
A adição de brometo de hidrogênio a [[alceno]]s antigamente era algo imprevisível, pois a adição ocorria de acordo com a [[regra de Markovnikov]], mas outras vezes, ela ocorria de modo contrário. Em 1929, Morris S. Kharasch concluiu, após vários experimentos, que reações de adição envolvendo peróxido, ou seja, composto orgânico do tipo ROOR, não seguia a regra de [[Markovnikov]]. Assim Kharasch propôs que o brometo de hidrogênio pode adicionar-se a alcenos por dois mecanismos diferentes: Adição eletrofílica e adição seguindo a regra anti- Markovnikov. |
||
Iremos focar na adição anti- Markovnikov, pois essa é uma reação em cadeia que envolve intermediários radicais livres, portanto, é o que nos interessa. |
Iremos focar na adição anti- Markovnikov, pois essa é uma reação em cadeia que envolve intermediários radicais livres, portanto, é o que nos interessa. |
||
| Linha 37: | Linha 42: | ||
'''Etapa 2:''' um desses radicais alcoxila retira um átomo hidrogênio do brometo de hidrogênio gerando assim um átomo de bromo. Com isso, dá inicio a fase de propagação da reação em cadeia. |
'''Etapa 2:''' um desses radicais alcoxila retira um átomo hidrogênio do brometo de hidrogênio gerando assim um átomo de bromo. Com isso, dá inicio a fase de propagação da reação em cadeia. |
||
'''Etapa 3 e 4:''' um átomo de bromo adiciona-se ao alceno na direção que produz o radical alquila mais estável. O radical mais estável seguirá a ordem de estabilidade (terciário > secundário > primário). Assim, o radical mais estável é formado mais rapidamente. |
'''Etapa 3 e 4:''' um átomo de bromo adiciona-se ao [[alceno]] na direção que produz o radical alquila mais estável. O radical mais estável seguirá a ordem de estabilidade (terciário > secundário > primário). Assim, o radical mais estável é formado mais rapidamente. |
||
O átomo de bromo se adiciona a ligação dupla. Posteriormente o radical alquila retira um átomo hidrogênio do brometo de hidrogênio originando então o produto brometo de alquila mostrado na Etapa 4. As etapas 3 e 4 são etapas de propagação, na qual o 1-bromobutano é o produto principal. |
O átomo de bromo se adiciona a ligação dupla. Posteriormente o radical [[alquila]] retira um átomo [[hidrogênio]] do brometo de hidrogênio originando então o produto brometo de alquila mostrado na Etapa 4. As etapas 3 e 4 são etapas de propagação, na qual o 1-[[bromobutano]] é o produto principal. |
||
Entre os haletos de hidrogênio somente o brometo de hidrogênio reage com alcenos pelos dois mecanismos: adição eletrofílica e via radicais livres. Em geral, o HBr reage por adição eletrofílica, mas se houver peróxido ou a reação for iniciada fotoquimicamente, é seguido o mecanismo de radical livre. |
Entre os haletos de hidrogênio somente o brometo de hidrogênio reage com alcenos pelos dois mecanismos: adição eletrofílica e via radicais livres. Em geral, o HBr reage por adição eletrofílica, mas se houver peróxido ou a reação for iniciada fotoquimicamente, é seguido o mecanismo de radical livre.<ref name=AdHH>[http://coral.ufsm.br/quimica_organica/arquivos/Adicao2012HB.pdf Adição Eletrofílica a Alcenos Haletos de Hidrogênio (HX)]</ref> |
||
Para as sínteses orgânicas, a possibilidade de ter dois caminhos diferentes para um brometo de hidrogênio e um alceno é uma vantagem, já que de um único alceno pode-se preparar um de dois diferentes brometos de alquila, através da escolha da reação mais favorável.<ref name=Carey>{{citar livro|autor={{smallcaps|Carey}}, Francis A.|título=Química Orgânica - Vol. 1 |ano=2008|editora=McGraw-Hill|local=São Paulo|isbn=978-0-07-304787-7}}</ref> |
Para as sínteses orgânicas, a possibilidade de ter dois caminhos diferentes para um brometo de hidrogênio e um alceno é uma vantagem, já que de um único alceno pode-se preparar um de dois diferentes brometos de alquila, através da escolha da reação mais favorável.<ref name=Carey>{{citar livro|autor={{smallcaps|Carey}}, Francis A.|título=Química Orgânica - Vol. 1 |ano=2008|editora=McGraw-Hill|local=São Paulo|isbn=978-0-07-304787-7}}</ref> |
||
==Formação de hidrogenossulfatos de alquila (via H<sub>2</sub>SO<sub>4</sub>):== |
==Formação de hidrogenossulfatos de alquila (via H<sub>2</sub>SO<sub>4</sub>):== |
||
Essa reação ocorre quando ácidos diferentes de haletos de hidrogênio se adicionam à ligação carbono-carbono de alcenos. Nesse caso, quando os alcenos são tratados com ácido sulfúrico concentrado a frio, eles reagem por meio de adição eletrofílica para formar hidrogenossulfatos de aquila. |
Essa reação ocorre quando ácidos diferentes de haletos de hidrogênio se adicionam à ligação [[carbono]]-carbono de alcenos. Nesse caso, quando os alcenos são tratados com [[ácido sulfúrico]] concentrado a frio, eles reagem por meio de adição eletrofílica para formar hidrogenossulfatos de aquila. |
||
;A Reação global |
;A Reação global |
||
| Linha 51: | Linha 56: | ||
;Mecanismo |
;Mecanismo |
||
Inicialmente o alceno aceita um próton do ácido sulfúrico. Essa reação segue a regra de Markovnikov, então o próton se ligará ao carbono mais hidrogenado para formar o carbocátion mais estável. |
Inicialmente o alceno aceita um [[próton]] do ácido sulfúrico. Essa reação segue a regra de Markovnikov, então o próton se ligará ao carbono mais hidrogenado para formar o carbocátion mais estável. |
||
[[Ficheiro: Mecanismo 1° parte da síntese de hidrogenossulfato.png |noframe|400px| Mecanismo 1° parte da síntese de hidrogenossulfato |semmoldura]] |
[[Ficheiro: Mecanismo 1° parte da síntese de hidrogenossulfato.png |noframe|400px| Mecanismo 1° parte da síntese de hidrogenossulfato |semmoldura]] |
||
| Linha 64: | Linha 69: | ||
== Hidratação de alcenos por catálise ácida == |
== Hidratação de alcenos por catálise ácida == |
||
{{VT|Hidratação (química)|l1=Hidratação}} |
|||
Nesta reação, um [[alceno]] reage com a água originando um [[álcool]]. |
Nesta reação, um [[alceno]] reage com a água originando um [[álcool]]. |
||
A [[Regioquímica|regiosseletividade]] da hidratação segue a [[regra de Markovnikov]], que determina que o hidrogênio seja ligado ao carbono menos substituído (com o maior número de hidrogênios). |
A [[Regioquímica|regiosseletividade]] da hidratação segue a [[regra de Markovnikov]], que determina que o hidrogênio seja ligado ao carbono menos substituído (com o maior número de hidrogênios).<ref name=AdHH /> |
||
Embora possa ser utilizado ácido concentrado, esta reação ocorre em meio ácido diluído, utilizando-se geralmente uma [[solução]] 50% [[água]]/[[ácido sulfúrico]], que permite a produção direta do [[álcool]] sem a necessidade de uma etapa adicional de hidrólise.<ref name=Carey/> |
Embora possa ser utilizado ácido concentrado, esta reação ocorre em meio ácido diluído, utilizando-se geralmente uma [[solução]] 50% [[água]]/[[ácido sulfúrico]], que permite a produção direta do [[álcool]] sem a necessidade de uma etapa adicional de hidrólise.<ref name=Carey/> |
||
| Linha 76: | Linha 84: | ||
==Epoxidação de alcenos== |
==Epoxidação de alcenos== |
||
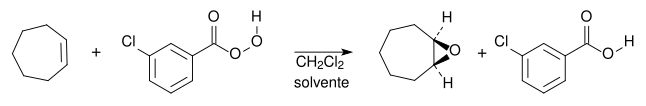
Os alcenos podem ser [[Oxidação|oxidados]] no tratamento com um peroácido ( |
Os alcenos podem ser [[Oxidação|oxidados]] no tratamento com um peroácido (<math>RCO_3H</math> , também conhecido como ácido peroxicarboxílico).<ref name=McMurry/> O grupo [[hidroxila]] (<math>OH^-</math>) em peroácidos contém um [[Eletrófilo|oxigênio eletrofílico]], que pode reagir com alcenos adicionando este oxigênio à ligação pi formando um [[epóxido]] (também chamado de oxirana).<ref name=Vollhardt/> A essa reação dá-se o nome de epoxidação. Um epóxido é um éter cíclico com um átomo de oxigênio em um anel de três membros. O outro produto da reação é um [[ácido carboxílico]]: |
||
[[File:Reação de epoxidação.svg|noframe|Reação geral de uma epoxidação]] |
[[File:Reação de epoxidação.svg|noframe|Reação geral de uma epoxidação]] |
||
===Mecanismo=== |
===Mecanismo=== |
||
A transferência do oxigênio é de [[Adição sin e anti|estereoquimicamente sin]], sendo a estereoquímica do alceno inicial mantida no produto – as duas ligações C-O se formam na mesma face da ligação dupla por meio de um mecanismo de etapa única sem intermediários. O átomo de hidrogênio mais distante do grupo carbonila é aquele que é transferido.<ref name=McMurry/> Na epoxidação, pode-se descrever um estado transicional cíclico no qual o oxigênio eletrofílico é adicionado à ligação pi ao mesmo tempo que o próton do peroácido é transferido para seu próprio grupo [[carbonila]], liberando uma molécula de ácido carboxílico, que é um bom grupo de saída. As duas novas ligações C-O no epóxido formado são formalmente derivadas dos pares de elétron da ligação pi do alceno e da ligação O-H clivada.<ref name=Vollhardt/> |
A transferência do oxigênio é de [[Adição sin e anti|estereoquimicamente sin]], sendo a estereoquímica do alceno inicial mantida no produto – as duas ligações <math>C-O</math> se formam na mesma face da ligação dupla por meio de um mecanismo de etapa única sem intermediários. O átomo de hidrogênio mais distante do grupo carbonila é aquele que é transferido.<ref name=McMurry/> Na epoxidação, pode-se descrever um estado transicional cíclico no qual o oxigênio eletrofílico é adicionado à [[ligação pi]] ao mesmo tempo que o próton do peroácido é transferido para seu próprio grupo [[carbonila]], liberando uma [[molécula]] de [[ácido carboxílico]], que é um bom grupo de saída. As duas novas ligações <math>C-O</math> no epóxido formado são formalmente derivadas dos pares de elétron da ligação pi do alceno e da ligação <math>O-H</math> clivada.<ref name=Vollhardt/> |
||
[[File:Mecanismo da epoxidação.svg|noframe|Mecanismo de uma reação de epoxidação]] |
[[File:Mecanismo da epoxidação.svg|noframe|Mecanismo de uma reação de epoxidação]] |
||
| Linha 89: | Linha 97: | ||
*{{smallcaps|Solomons}}, T. W. Graham. "Organic chemistry"; Jonh Wiley & Sons, Inc; 6th ed.;1996;ISBN 0-471-01342-0 |
*{{smallcaps|Solomons}}, T. W. Graham. "Organic chemistry"; Jonh Wiley & Sons, Inc; 6th ed.;1996;ISBN 0-471-01342-0 |
||
*{{smallcaps|Carey}}, Francis A.. Química Orgânica - Vol. 1. São Paulo: McGraw-Hill, 2008. ISBN 978-0-07-304787-7 |
*{{smallcaps|Carey}}, Francis A.. Química Orgânica - Vol. 1. São Paulo: McGraw-Hill, 2008. ISBN 978-0-07-304787-7 |
||
{{Portal-química}} |
|||
{{portal3|Química}} |
{{portal3|Química}} |
||
Revisão das 07h31min de 17 de agosto de 2014
Em química orgânica, uma adição eletrofílica ou eletrófila ( ou ) é uma reação de adição onde em um composto químico, o substrato da reação, se perde um ligação pi para permitir a formação de duas novas ligações sigma. Nas reações de adição eletrofílica, os substratos mais comuns tem ligações duplas ou ligações triplas carbono-carbono.[1]
Eletrófilos são ácidos de Lewis, moléculas ou íons que pode aceitar um par de elétrons. Qualquer reação de um eletrófilo também envolve um nucleófilo. O protonamento de um alceno, eletrófilo é o próton doado por um ácido, e o nucleófilo é o alceno. Estão inclusos reagentes positivos, tais como prótons, reagentes neutros, tais como bromo, e os ácidos de Lewis e .[2]
Reação de Halogenação
A halogenação de um alcano se dá por substituição de um átomo de hidrogênio por um halogênio, resultando em um haleto de alquila ( isso pode ocorrer em um ou mais átomos de hidrogênio ). Por exemplo, na cloração do metano e do etano os produtos são, respectivamente, cloro metano e cloro etano. Para alcanos com mais de dois carbonos existe mais de uma possibilidade para o halogênio se posicionar. Deste modo o produto da reação será uma mistura de isômeros de posição. Entretanto, as quantidades dos isômeros formados diferem-se na mistura. A reação ocorre via radicais livres.[3]
Tomemos como exemplo a bromação do propano. As quantidades de 1-bromopropano e 2-bromopropano obtidas dependem das velocidades relativas a que os radicais n-propial e isopropila se formam. Se os radicais isopropila se formarem mais rapidamente será também o 2-bromopropano o que se formará mais rapidamente e o que constitui, portanto, a maior parte dos produtos da reação. Devemos então comparar as velocidades relativas em que os hidrogênios primários e secundários são subtraídos do propano. A quantidade de cada composto será proporcional à seguinte ordem de facilidade com que o hidrogênio é liberado na molécula:
De acordo com isso teremos a reação de bromação abaixo:
Relativo à velocidades e a escolha do produto principal, tomamos por base as velocidades relativas de subtração do hidrogênio: H primário = 1,0 H secundário = 3,8 H terciário = 5,0 O propano tem seis hidrogênios primários e dois hidrogênios secundários, portanto: para H primário: 6 x 1,0 = 6,0 para H secundário: 2 x 3,8 = 7,6 total: 6,0 + 7,6 = 13,6 13,6 corresponde a 100% das velocidades relativas. Logo, por regra de três simples, temos que 7,6 (H primário) corresponde a aproximadamente 55,9% e que 6,0 (H secundário) corresponde a 44,1%. Essas porcentagens são as quantidades relativas dos radicais n-propila e isopropila formados e, consequentemente, também dos produtos formados. Percebe-se então que o radical substituído no carbono secundário, isto é, o radical isopropila, forma-se mais rapidamente que o n-propila, o que leva a uma maior rapidez na formação do 2-bromopropano, logo ele será o produto principal formado.
A reação se divide em três etapas principais, a iniciação, propagação e a terminação. A iniciação envolve a clivagem de uma molécula de cloro, pelo calor ou pela luz, em dois átomos de cloro. Na propagação, um átomo de cloro abstrai um de hidrogênio da molécula de metano, produzindo uma molécula de cloreto de hidrogênio () e um radical metila. Na etapa final, o radical metila, altamente reativo, reage com a molécula do cloro () através da abstração de um átomo de cloro. Isso resulta na formação de uma molécula de clorometano e um átomo de cloro. Este último pode atacar uma outra molécula de metano e causar a repetição da etapa 2, depois da etapa 3... etapa 2, 3... centenas de vezes. Esse tipo de sequência é chamado de efeito em cadeia. A reação em cadeia pode ser encerrada por uma etapa conhecida como “terminação de cadeia”.
Adição via radicais livres por HBr
A adição de brometo de hidrogênio a alcenos antigamente era algo imprevisível, pois a adição ocorria de acordo com a regra de Markovnikov, mas outras vezes, ela ocorria de modo contrário. Em 1929, Morris S. Kharasch concluiu, após vários experimentos, que reações de adição envolvendo peróxido, ou seja, composto orgânico do tipo ROOR, não seguia a regra de Markovnikov. Assim Kharasch propôs que o brometo de hidrogênio pode adicionar-se a alcenos por dois mecanismos diferentes: Adição eletrofílica e adição seguindo a regra anti- Markovnikov. Iremos focar na adição anti- Markovnikov, pois essa é uma reação em cadeia que envolve intermediários radicais livres, portanto, é o que nos interessa.
Adição anti- Markovnikov:
Vamos nos basear na Adição via radicais livres de brometo de hidrogênio, observe o quadro abaixo:

Etapa 1: os peróxidos iniciam o processo agindo como fonte de radicais livres necessários para a reação em cadeia começar. A ligação oxigênio-oxigênio é relativamente fraca, assim a adição via radicais livres do brometo de hidrogênio a alcenos começa com a produção de dois alcoxi, que vieram da quebra do peróxido.
Etapa 2: um desses radicais alcoxila retira um átomo hidrogênio do brometo de hidrogênio gerando assim um átomo de bromo. Com isso, dá inicio a fase de propagação da reação em cadeia.
Etapa 3 e 4: um átomo de bromo adiciona-se ao alceno na direção que produz o radical alquila mais estável. O radical mais estável seguirá a ordem de estabilidade (terciário > secundário > primário). Assim, o radical mais estável é formado mais rapidamente. O átomo de bromo se adiciona a ligação dupla. Posteriormente o radical alquila retira um átomo hidrogênio do brometo de hidrogênio originando então o produto brometo de alquila mostrado na Etapa 4. As etapas 3 e 4 são etapas de propagação, na qual o 1-bromobutano é o produto principal.
Entre os haletos de hidrogênio somente o brometo de hidrogênio reage com alcenos pelos dois mecanismos: adição eletrofílica e via radicais livres. Em geral, o HBr reage por adição eletrofílica, mas se houver peróxido ou a reação for iniciada fotoquimicamente, é seguido o mecanismo de radical livre.[3]
Para as sínteses orgânicas, a possibilidade de ter dois caminhos diferentes para um brometo de hidrogênio e um alceno é uma vantagem, já que de um único alceno pode-se preparar um de dois diferentes brometos de alquila, através da escolha da reação mais favorável.[4]
Formação de hidrogenossulfatos de alquila (via H2SO4):
Essa reação ocorre quando ácidos diferentes de haletos de hidrogênio se adicionam à ligação carbono-carbono de alcenos. Nesse caso, quando os alcenos são tratados com ácido sulfúrico concentrado a frio, eles reagem por meio de adição eletrofílica para formar hidrogenossulfatos de aquila.
- A Reação global
- Mecanismo
Inicialmente o alceno aceita um próton do ácido sulfúrico. Essa reação segue a regra de Markovnikov, então o próton se ligará ao carbono mais hidrogenado para formar o carbocátion mais estável.
Em seguida o ânion hidrogenossulfato reage com o carbocátion formando o hidrogenossulfato de alquila. Como se trata de uma reação regiosseletiva, temos a formação do isopropil-hidrogenossulfato ao invés do propil hidrogenossulfato.
Os hidrogenossulfatos de alquila podem sofrer hidrólise e serem convertidos a álcoois quando aquecidos com água, como mostrado a seguir:
Hidratação de alcenos por catálise ácida
Nesta reação, um alceno reage com a água originando um álcool.
A regiosseletividade da hidratação segue a regra de Markovnikov, que determina que o hidrogênio seja ligado ao carbono menos substituído (com o maior número de hidrogênios).[3] Embora possa ser utilizado ácido concentrado, esta reação ocorre em meio ácido diluído, utilizando-se geralmente uma solução 50% água/ácido sulfúrico, que permite a produção direta do álcool sem a necessidade de uma etapa adicional de hidrólise.[4]
Na hidratação ácida todas as etapas do processo são reversíveis. O próton age apenas como catalisador e não é consumido na reação geral.[5] Apesar de particularmente apropriado para reações industriais em larga escala, esse processo torna-se de pouco valor em escala laboratorial por exigir condições fortemente ácidas e alta temperatura (250ºC no caso do etileno).[6]
Mecanismo
Na primeira etapa do mecanismo de reação, a ligação pi reage com um próton, formando o carbocátion mais estável.[7]Este carbocátion é planar e pode reagir com uma molécula de água pela face superior ou inferior – esta etapa não é estereosseletiva. A água age como um nucleófilo para capturar o cátion terc-butila. A última etapa envolve a perda de um próton pelo íon oxônio resultante da adição de água.
Epoxidação de alcenos
Os alcenos podem ser oxidados no tratamento com um peroácido ( , também conhecido como ácido peroxicarboxílico).[6] O grupo hidroxila () em peroácidos contém um oxigênio eletrofílico, que pode reagir com alcenos adicionando este oxigênio à ligação pi formando um epóxido (também chamado de oxirana).[5] A essa reação dá-se o nome de epoxidação. Um epóxido é um éter cíclico com um átomo de oxigênio em um anel de três membros. O outro produto da reação é um ácido carboxílico:
Mecanismo
A transferência do oxigênio é de estereoquimicamente sin, sendo a estereoquímica do alceno inicial mantida no produto – as duas ligações se formam na mesma face da ligação dupla por meio de um mecanismo de etapa única sem intermediários. O átomo de hidrogênio mais distante do grupo carbonila é aquele que é transferido.[6] Na epoxidação, pode-se descrever um estado transicional cíclico no qual o oxigênio eletrofílico é adicionado à ligação pi ao mesmo tempo que o próton do peroácido é transferido para seu próprio grupo carbonila, liberando uma molécula de ácido carboxílico, que é um bom grupo de saída. As duas novas ligações no epóxido formado são formalmente derivadas dos pares de elétron da ligação pi do alceno e da ligação clivada.[5]
Referências
- ↑ March, Jerry; (1985). Advanced Organic Chemistry reactions, mechanisms and structure (3rd ed.). New York: John Wiley & Sons, inc. ISBN 0-471-85472-7
- ↑ Adição Eletrofílica
- ↑ a b c Adição Eletrofílica a Alcenos Haletos de Hidrogênio (HX)
- ↑ a b Carey, Francis A. (2008). Química Orgânica - Vol. 1. São Paulo: McGraw-Hill. ISBN 978-0-07-304787-7 Verifique
|isbn=(ajuda) templatestyles stripmarker character in|autor=at position 1 (ajuda) - ↑ a b c Vollhardt, K.; Peter, C. (2011). Organic chemistry : structure and function. Nova Iorque: W. H. Freeman and Company. ISBN 978-1-4292-0494-1 templatestyles stripmarker character in
|autor=at position 1 (ajuda) - ↑ a b c McMurry, John. (2011). Química Orgânica - Volume 1. São Paulo: Cengage Learning. ISBN 978-85-221-1008-7 templatestyles stripmarker character in
|autor=at position 1 (ajuda) - ↑ Parrill, Abby. «Acid Catalyzed Hydration». Consultado em 8 de agosto de 2013 templatestyles stripmarker character in
|autor=at position 1 (ajuda)
Bibliografia
- Solomons, T. W. Graham. "Organic chemistry"; Jonh Wiley & Sons, Inc; 6th ed.;1996;ISBN 0-471-01342-0
- Carey, Francis A.. Química Orgânica - Vol. 1. São Paulo: McGraw-Hill, 2008. ISBN 978-0-07-304787-7