Indução assimétrica
Indução assimétrica (também chamada de enantioindução) em estereoquímica descreve a formação preferencial em uma reação química de um enantiômero ou diastereoisômero sobre o outro como resultado da influência de uma característica quiral presente no substrato, reagente, catalisador ou ambiente.[1] A indução assimétrica é um elemento chave na síntese assimétrica.
Indução assimétrica foi introduzida por Hermann Emil Fischer baseado em seu trabalho sobre carboidratos.[2] Existem vários tipos de indução assimétrica.
Indução assimétrica interna faz uso de uma centro quiral ligado ao centro reativo através de uma ligação covalente e permanece assim durante a reação. O material de partida é muitas vezes derivado da síntese de pool quiral. Na indução assimétrica retransmitida, a informação quiral é introduzida em um passo separado e removida novamente em uma reação química separada. Os síntons especiais são chamados auxiliares quirais. Na indução assimétrica externa, a informação quiral é introduzida no estado de transição através de um catalisador de ligando quiral. Este método de síntese assimétrica é economicamente mais desejável.
Indução assimétrica carbonilo 1,2
[editar | editar código-fonte]Existem vários modelos para descrever a indução quiral em carbonos de carbonilo durante adições nucleofílicas. Estes modelos são baseados em uma combinação de considerações estéricas e eletrônicas e estão muitas vezes em conflito uns com os outros. Modelos foram criados por Cram (1952), Cornforth (1959), Felkin (1969) e outros.
Regra de Cram
[editar | editar código-fonte]A regra de Cram de indução assimétrica desenvolvida por Donald J. Cram em 1952[3] é um conceito inicial em relação à previsão da estereoquímica em certos sistemas acíclicos. A pleno a regra é:
- Em certas reações não catalíticas em que diastereômeros predominarão, o que poderia ser formado pela abordagem do grupo que entra a partir do lado menos impedido quando a conformação de rotação da ligação C-C é tal que a ligação dupla é flanqueada pelos dois grupos menos volumosos ligados ao centro assimétrico adjacente.
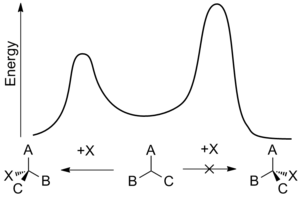
A regra indica que a presença de um centro assimétrico em uma molécula induz a formação de um centro assimétrico adjacente a ele com base em impedimento estérico.
Em sua publicação de 1952, Cram apresentou um grande número de reações descritas na literatura para as quais a conformação dos produtos de reação poderia ser explicada com base nesta regra e também descreveu um experimento elaborado (esquema 1) defendendo sua tese.
Os experimentos envolveram duas reações. No experimento um 2-fenilpropionaldeído (1, racêmico mas mostrado o (R)-enantiômero) reagiu com o reagente de Grignard de bromobenzeno a 1,2-difenil-1-propanol (2) como uma mistura de diastereômeros, predominantemente o isômero treo (veja para explicação a projeção de Fischer).
A preferência pela formação do isômero treo pode ser explicada pela regra indicada acima por ter o nucleófilo ativo nsta reação atacando o grupo carbonilo do lado menos impedido (ver projeção de Newman A) quando o carbonilo é posicionado em uma formação escalonada com o grupo metil e o átomo de hidrogênio, os quais são os dois menores substituintes criando um mínimo de impedimento estérico, em uma orientação de calibre e fenil como o grupo mais volumoso na conformação anti.
A segunda reação é a redução orgânica de 1,2-difenil-1-propanona 2 com hidreto de alumínio e lítio, o qual resulta no mesmo produto da reação que o acima, mas agora com preferência pelo isômero eritro (2a). Agora um ânion hidreto (H−) é o nucleófilo atacando do lado menos impedido (imagine o hidrogênio entrando do plano do esquema).
Na publicação original de 1952, foram obtidas evidências adicionais para a atribuição estrutural dos produtos de reação, aplicando-os a uma eliminação de Chugaev, em que o isômero treo reage ao isômero cis de -α-metil-estilbeno e o isômero eritro à versão trans.
Modelo de Felkin
[editar | editar código-fonte]O modelo de Felkin (1968), nomeado em homenagem a Hugh Felkin, também prediz a estereoquímica de reações de adição nucleofílica a grupos carbonilo.[4] Felkin argumentou que o modelo de Cram sofria de uma grande desvantagem: uma conformação eclipsada no estado de transição entre o substituinte de carbonilo (o átomo de hidrogênio em aldeídos) e o maior substituinte α-carbonilo. Ele demonstrou que, ao aumentar o volume estérico do substituinte carbonilo de grupo metil para etilo e do isopropilo para isobutilo, a estereosselectividade também aumentava, o que não é previsto pela regra de Cram:
As regras de Felkin são:
- Os estados de transição são é como reagentes.
- Tensão de torção (tensão de Pitzer), TT, envolvendo ligações parciais (em estados de transição) representa uma fração substancial da tensão entre ligações totalmente formadas, mesmo quando o grau de ligação é bastante baixo. A conformação na TT é escalonada e não eclipsada com o substituinte R obliquo em relação a dois grupos adjacentes, um deles menor em TT A.
- Para comparação TT B é o estado de transição de Cram.
- As principais interações estéricas envolvem aquelas em torno de R e o nucleófilo, mas não o átomo de oxigênio do carbonilo.
- Um efeito polar ou efeito eletrônico estabiliza um estado de transição com máxima separação entre o nucleófilo e um grupo de remoção de elétrons. Por exemplo, halocetonas não obedecem à regra de Cram e, no exemplo acima, substituir o grupo de remoção de elétrons fenil por um grupo ciclohexil de reduz consideravelmente a estereosseletividade.
Modelo Felkin-Ahn
[editar | editar código-fonte]O modelo Felkin-Ahn[nota 1] é uma extensão do modelo Felkin que incorpora melhorias sugeridas por Nguyễn Trọng Ahn e Odile Eisenstein para corrigir duas fraquezas-chave no modelo de Felkin. A primeira fraqueza abordada foi a afirmação de Felkin de um forte efeito polar nos estados de transição de adição nucleofílica, o que leva à inversão completa da estereoquímica por reações SN2, sem oferecer justificativas quanto ao motivo pelo qual esse fenômeno foi observado. A solução de Ahn oferece o efeito antiperiplanar como conseqüência da indução assimétrica sendo controlada tanto pelo substituinte quanto por efeitos orbitais.[5][6] Neste efeito, o orbital σ*, melhor aceitador de nucleófilos é alinhado paralelamente a ambos os orbitais π e π* do carbonilo, o qual provê a estabilização do ânion entrante.
A segunda fraqueza no modelo de Felkin foi a suposição da minimização de substituintes em torno do carbonilo R, a qual não pode ser aplicado a aldeídos.
Incorporação das ideias do ângulo Bürgi-Dunitz[7][8] permitiu a Anh postular um ataque não perpendicular pelo nucleófilo sobre o centro de carbonilo, em qualquer posição de 95° a 105° em relação à ligação dupla de oxigênio-carbono, favorecendo uma aproximação mais próxima do substituinte menor e assim resolvendo o problema da previsibilidade para os aldeídos.[5][9][10]
Seletividade anti–Felkin
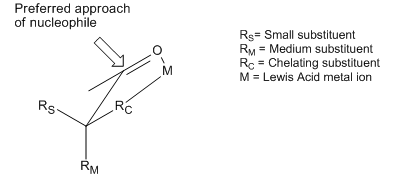
[editar | editar código-fonte]Embora o modelos de Cram e Felkin–Anh diferem nas suposições consideradas de conformadores e outros, ambos tentam explicar o mesmo fenômeno básico: a adição preferencial de um nucleófilo a face mais estericamente favorecida de uma fração carbonilo. No entanto, existem muitos exemplos de reações que exibem estereosseletividade oposta ao que é prevista pelos princípios básicos dos modelos Cram e Felkin-Anh. Embora ambos os modelos incluam tentativas de explicar essas reversões, os produtos obtidos ainda são referidos como produtos "anti-Felkin". Um dos exemplos mais comuns da seletividade de indução assimétrica alterada requer um carbono-α substituído com um componente com caráter de base de Lewis (i.e. substituintes O, N, S, P). Nesta situação, se um ácido de Lewis tal como Al-iPr2 ou Zn2+ é introduzido um efeito de quelação bidentada que pode ser observado. Isso bloqueia o carbonilo e o substituinte base de Lewis em uma conformação eclipsada, e o nucleófilo irá então atacar do lado com o menor substituinte carbono-α livre.[11] Se o grupo quelando R é identificado como o maior, isto irá resultar em um produto "anti-Felkin".
Este controle de estereosseletividade foi reconhecida e discutida no primeiro artigo estabelecendo o modelo de Cram, fazendo com que Cram afirme que seu modelo requer condições não quelantes.[12] Um exemplo de controle de quelação de uma reação pode ser visto aqui, de um artigo de 1987 que foi o primeiro a observar diretamente tal intermediário "Cram-quelato",[13] sustentando o modelo::
Aqui, o cloreto de metil titânio forma um Cram-quelato. O grupo metilo, em seguida, dissocia-se do titânio e ataca o carbonilo, conduzindo ao diastereômero anti-Felkin.
Um efeito substituinte sem remoção de elétrons não-quelante também pode resultar em seletividade anti-Felkin. Se um substituinte no carbono α tiver suficientemente retirada de elétrons, o nucleófilo irá adicionar anti- relativo ao grupo de remoção de elétrons (GRE), mesmo se o substituinte não for o maior dos 3 ligados ao carbono α. Cada modelo oferece uma explicação um pouco diferente para esse fenômeno. Um efeito polar foi postulado pelo modelo de Cornforth[14] e o modelo Felkin original,[15] que colocou o GRE substituinte e nucleófilo em introdução anti- a cada outro de maneira para efetivamente cancelar o momento dipolar da estrutura de transição.
Esta projeção de Newman illustra estado de transição Cornforth e Felkin que colocou o GRE anti- ao nucleófilo,em introdução independentemente do seu volume estérico relativo a RS and RL.
O modelo Felkin–Anh melhorado, como discutido acima, faz uma avaliação mais sofisticada do efeito polar considerando as interações de orbital molecular na estabilização do estado de transição preferido. Uma típica reação ilustrando o potencial de seletividade anti-Felkin deste efeito, junto com sua estrutura de transição proposta, é ilustrada abaixo:
Indução assimétrica carbonilo 1,3
[editar | editar código-fonte]Tem sido observado que o ambiente estereoeletrônico no carbono β também pode direcionar a indução assimétrica. Uma série de modelos preditivos evoluíram ao longo dos anos para definir a estereosseletividade de tais reações.
Modelo de quelação
[editar | editar código-fonte]De acordo com Reetz, o modelo Cram-quelato para induções 1,2 ode ser estendido para prever o complexo quelado de um alcóxi β de aldeído e metal. O nucleófilo é visto atacando do lado menos estéricamente impedido e anti- ao substituinte Rβ, conduzindo ao anti-aduto como o principal produto.[16]
Para produzir tais quelatos, o centro metálico deve ter pelo menos dois locais de coordenação livres e os ligandos de proteção devem formar um complexo bidentado com o ácido de Lewis.
Modelo de não-quelação
[editar | editar código-fonte]Modelo de Cram–Reetz
[editar | editar código-fonte]Cram e Reetz demonstraram que o estereocontrole 1,3 é possível se a reação ocorre através de um estado de transição acíclico. A reação de aldeído alcóxi β com aliltrimetilsilano mostrou boa seletividade para o anti-1,3-diol, a qual era explicado pelo modelo polar de Cram. O grupo benziloxi polar é orientado anti para o carbonilo para minimizar as interações do dipolo e os ataques nucleófilos anti- ao mais volumoso (RM) dos dois substituintes remanescente.[17][18]
Modelo de Evans
[editar | editar código-fonte]Mais recentemente, Evans apresentou um modelo diferente para induções 1,3 não quelato. No estado de transição proposto, o β-estereocentro é orientado anti- ao nucleófilo em introdução, como visto no modelo Felkin–Anh. O grupo polar X no β-estereocentro é posicionado anti- ao carbonilo para reduzir interações dipolo, e Rβ é posicionado anti- ao grupo aldeído para minimizar o impedimento estérico. Consequentemente, o 1,3-anti-diol seria previsto como o principal produto.[19]
Indução assimétrica carbonilo 1,2 e 1,3
[editar | editar código-fonte]Se o substrato tem tanto o α- e o β-estereocentros, a regra Felkin–Anh (indução 1,2) e o modelo de Evans (indução 1,3) devem ser considerados ao mesmo tempo. Se estes dois estereocentros tem uma relação anti-, ambos os modelos prevêem o mesmo diastereômero (o caso de estereorreforço).
No entanto, no caso de sin-substrato, o modelo de Felkin–Anh e o de Evans predizem diferentes produtos (caso de não-estereorreforço). Tem sido verificado que o tamanho do nucleófilo em introdução determina o tipo de controle exercido sobre a estereoquímica. No caso de um nucleófilo grande, a interação do α-estereocentro com o nucleófilo em introdução torna-se dominante; Portanto, o produto Felkin é o principal. Os nucleófilos menores, por outro lado, resultam em controle 1,3 determinando a assimetria.[20]
Indução assimétrica de alcenos acíclicos
[editar | editar código-fonte]Alcenos acíclicos quirais também apresentam diaestereosseletividade em reações tais como epoxidação e alquilação de enolato. Os substituintes em torno do alceno podem favorecer a aproximação do eletrófilo de um ou de outro lado da molécula. Esta é a base do modelo de Houk, baseado no trabalho teórico de Kendall Houk, o qual prevê que a seletividade seja mais forte para ligações duplas cis que para trans.[21]
No modelo mostrado, o alceno cis assume a conformação mostrada para minimizar choque estérico entre RS e o grupo metil. A abordagem do eletrófilo ocorre preferencialmente do mesmo lado do grupo médio (RM) em vez do grupo maior (RL), produzindo principalmente o diastereoisômero mostrado. Dado que para um alceno trans o impedimento estérico entre RS e o grupo H não é maior que para o caso cis, a seletividade é muito menor.



Controle de substrato: indução assimétrica por estrutura molecular em sistemas acíclicos
[editar | editar código-fonte]Indução assimétrica por estrutura molecular de um substrato acíclico é a ideia que as propriedades assimétricas estéricas e eletrônicas de uma molécula podem determinar a quiralidade por reações químicas subsequentes nesta molécula. Este princípio é usado para projetar sínteses químicas onde um estereocentro está no lugar e estereocentros adicionais são necessários.
Quando considera-se como dois grupos funcionais ou espécies reagem, as configurações 3D precisas das entidades químicas envolvidas determinarão como elas podem se aproximar uma da outra. Qualquer restrição quanto à forma como essas espécies podem se aproximar determinará a configuração do produto da reação. No caso da indução assimétrica, estamos considerando os efeitos de um centro assimétrico em uma molécula sobre a reatividade de outros grupos funcionais dessa molécula. Quanto mais próximos estes dois sítios são, maior será a influência que se observa. Uma abordagem mais holística para avaliar esses fatores é por modelagem computacional,[22] no entanto, fatores qualitativos simples também podem ser usados para explicar as tendências predominantes observadas em algumas etapas sintéticas. A facilidade e precisão desta abordagem qualitativa significa que é mais comumente aplicada no projeto de síntese e substrato. Exemplos de estruturas moleculares apropriadas são os aldeídos alfa-quirais e o uso de auxiliares quirais.
Indução assimétrica em aldeídos alfa-quirais
[editar | editar código-fonte]A possível reatividade em aldeídos incluem ataque nucleofílico e adição de alilmetais. A estereosseletividade do ataque nucleofílico em aldeídos alfa-quirais pode ser descrita pelos modelos Felkin-Anh ou Felkin Anh polar e a adição de alilmetais aquirais pode ser descrita pela regra de Cram.
Modelo Felkin-Anh e Felkin-Anh polar l
[editar | editar código-fonte]Seletividade em adições nucleofílicas a aldeídos quirais são frequentemente explicadas pelo modelo Felkin-Anh[23] (ver figura). O nucleófilo aproxima-se do carbono do grupo carbonilo no ângulo de Burgi-Dunitz.[24] Nesta trajetória, o ataque da face inferior é desfavorável devido ao volume estérico do grande grupo funcional adjacente.
O modelo Felkin-Anh polar é aplicado no cenário onde X é um grupo eletronegativo. O model Felkin-Anh polar postula que a estereoquímica observada surge devido à estabilização hiperconjugativa decorrente da interação anti-periplanar entre o orbital σ* de antiligação C-X e a ligação formada.
Melhora na seletividade de Felkin-Anh para adições organometálicas a aldeídos pode ser alcançado usando-se nucleófilos organo-alumínio em vez dos correspondentes nucleófilos de Grignard ou organolítio. Claude Spino e colaboradores[25] tem demonstrado significativas melhorias de estereosseletividade ao mudar de reagentes vinilgrignard a vinylalanos com uma variedade de aldeídos quirais.
Regra de Cram
[editar | editar código-fonte]Adição de alilmetálicos aquirais a aldeídos forma um álcool quiral, o resultado estereoquímico desta reação é determinado pela quiralidade do carbono α sobre o substrato aldeído (Figure "Controle de substrato: adição de alilmetais aquirais a aldeídos α-quirais"). Os reagentes alilmetálicos usados incluem boro, estanho e titânio.
A regra de Cram explica a estereosseletividade considerando o estado de transição descrito na figura 3. No estado de transição o par solitário do oxigênio é capaz de interagir com o centro de boro enquanto o grupo alil está apto a adicionar-se ao carbono final do grupo carbonilo. A demanda estérica deste estado de transição é minimizada pela configuração do carbono α mantendo o grupo maior longe do (trans a) o congestionado grupo carbonilo e o grupo alilmetal aproximando-se após o menor grupo sobre o carbono α central. No exemplo abaixo (Figura "Um exemplo de adição de substrato controlado de alil-boro aquiral a aldeído α-quiral"), (R)-2-metilbutanal (1) reage com o reagente alilboro (2) com dois possíveis diastereômero dos quais o (R, R)-isômero é o produto principal. O modelo de Cram desta reação é mostrado com o grupo carbonilo posicionado trans ao grupo etil (o grupo maior) e o alil boro aproximando-se após o hidrogênio (o grupo menor). A estrutura é mostrada em projeção de Newman. Neste caso a reação de adição nucleofílica ocorre na face onde o hidrogênio (o grupo menor) está produzindo o (R, R)-isômero como produto principal.
Auxiliares quirais
[editar | editar código-fonte]Estereoindução assimétrica pode ser alcançada com o uso de auxiliares quirais. Auxiliares quirais podem ser anexados de forma reversível ao substrato, induzindo uma reação diastereoseletiva antes da clivagem, produzindo globalmente um processo enantiosseletivo. Exemplos de auxiliares quirais incluem’ oxazolidinonas quirais auxiliares de Evans (para reações aldólicas assimétricas)[26] amidas pseudoefedrinas e iminas tert-butanossulfinamida.
Controle por reagentes: adição de alilmetais quirais a aldeídos aquirais
[editar | editar código-fonte]Em síntese orgânica, o controle por reagentes é uma abordagem para seletivamente formar um estereoisômero entre muitos, a estereosseletividade é determinada pela estrutura e quiralidade do reagente usado. Quando alilmetais quirais são usados para reação de adição nucleofílica a aldeídos aquirais, a quiralidade do álcool do carbono recentemente gerado é determinada pela quiralidade dos reagentes alilmetais (Figura 1). A quiralidade dos alilmetais normalmente advém dos ligantes assimétricos usados. Os metais nos reagentes alimmetálicos incluem boro, estanho, titânio, silício, etc.

Vários ligandos quirais foram desenvolvidos para preparar alilmetais quiral para a reação com aldeídos. H. C. Brown foi o primeiro a reportar os reagentes alilboro quirais para reações de alilação assimétrica com aldeídos.[27] Os reagentes alilboro quirais foram sintetizados do produto natural (+)-a-pineno em duas etapas. Os ligandos TADDOL desenvolvidos por Dieter Seebach tem sido usados para preparar compostos aliltitânio quirais por alilação assimétrica com aldeídos.[28] Jim Leighton tem desenvolvido compostos alilsilício quirais nos quais a libertação da tensão do anel facilita a reação de alilação estereosseletiva, 95% a 98% de excesso enantiomérico pode ser alcançado por uma variedade de aldeídos aquirais.[29]

Notas
- ↑ Vale ressaltar que em vietnamita, o sobrenome é dado em primeiro lugar, e então seria melhor chamado de Modelo Felkin-Nguyen.
Ver também
[editar | editar código-fonte]Referências
- ↑ Definição do termo no Gold Book da IUPAC]
- ↑ Asymmetric Synthesis of Natural Products, Ari Koskinen ISBN 0-471-93848-3
- ↑ Studies in Stereochemistry. X. The Rule of "Steric Control of Asymmetric Induction" in the Syntheses of Acyclic Systems Donald J. Cram, Fathy Ahmed Abd Elhafez J. Am. Chem. Soc.; 1952; 74(23); 5828–5835. Abstract
- ↑ Torsional strain involving partial bonds. The stereochemistry of the lithium aluminium hydride reduction of some simple open-chain ketones Marc Chérest, Hugh Felkin and Nicole Prudent Tetrahedron Letters Volume 9, Issue 18, 1968, Pages 2199-2204 doi:10.1016/S0040-4039(00)89719-1
- ↑ a b Ahn, N. T.; Eisenstein, O. Nouv. J. Chim. 1977, 1, 61.
- ↑ Ahn, N. T.; Eisenstein, O.; Lefour, J-M.; Dau, M-E. J. Am. Chem. Soc. 1973, 95, 6146.
- ↑ Bürgi, H. B.; Dunitz, J. D.; Shefter, E. J. Am. Chem. Soc. 1973, 95, 5065.
- ↑ Bürgi, H. B.; Dunitz, J. D.; Lehn, J. M.; Wipff, G. Tetrahedron 1974, 30, 1563.
- ↑ Anh, N. T.; Eisenstein, O. Tetrahedron Lett. 1976, 155.
- ↑ Anh, N. T. Top. Curr. Chem. 1980, 88, 146.
- ↑ Mengel A., Reiser O.Chem. Rev., 1999, 99 (5), 1191–1224.
- ↑ Cram DJ, Elhafez FA. J. Am. Chem. Soc.; 1952; 74(23); 5828–5835.
- ↑ Reetz MT, Hullmann M, Seitz T. Angew. Chem. Int. Ed. Engl. 1987. 26, 477–480.
- ↑ Cornforth JW, Cornforth MRH, Mathew KK. J. Chem.Soc. 1959, 112–127.
- ↑ Cherest M, Felkin H, Prudent N. Tetrahedron Lett. 1968, 18, 2199–2204.
- ↑ Reetz, M.T.; Jung, A. J. Am. Chem. Soc, 1983, 105, 4833.
- ↑ Leitereg, T.J.; Cram, D.J. J. Am. Chem. Soc. 1968, 90, 4011.
- ↑ Reetz. M.T.; Kesseler, K.; Jung, A. Tetrahedron Lett. 1984, 25, 729.
- ↑ Evans, D.A.; Duffy, J.L.; Dart, M.J. Tetrahedron Lett. 1994, 35, 8537.
- ↑ Evans, D.A.; Dart, M.J.; Duffy, J.L.; Yang, M.G. J .Am. Chem. Soc. 1996, 118, 4322.
- ↑ Clayden; Greeves; Warren; Wothers (2001). Organic Chemistry. [S.l.]: Oxford University Press. p. 895. ISBN 0-19-850346-6
- ↑ Houk, K. N. et al., Science, 1986, 231, 1108-1117.
- ↑ a) Anh, N. T. Top. Curr. Chem. 1980, 88, 145–162; (b) Anh, N. T.; Eisenstein, O. Nouv. J. Chim. 1977, 1, 61–70; (c) Anh, N. T.; Eisenstein, O. Tetrahedron Lett. 1976, 26, 155–158.
- ↑ Burgi, H. B.; Dunitz, J. D.; Lehn, J. M.; Wipff, G. Tetrahedron. 1974. 12, 1563–1572.
- ↑ Spino, C.; Granger, M. C.; Boisvert, L.; Beaulieu, C. Tetrahedron Lett. 2002, 43, 4183–4185.
- ↑ Evans, D. A.; Bartroli, J.; Shih, T. L., Am. Chem. Soc., 1981, 103, 2127-2129.
- ↑ Brown, H. C.; Jadhav, P. K. J. Am. Chem. Soc. 1983, 105, 2092.
- ↑ Duthaler, R. O.; Hafner, A. Chem. Rev. 1992, 92, 807.
- ↑ Kinnaird, J. W. A.; Ng, P. Y.; Kubota, K.; Wang, X.; Leighton, J. L. J. Am. Chem. Soc. 2002, 124, 7920.
Ligações externas
[editar | editar código-fonte]- The Evolution of Models for Carbonyl Addition Evans Group Afternoon Seminar Sarah Siska February 9, 2001