Pentóxido de fósforo
| Pentóxido de difósforo Alerta sobre risco à saúde | |
|---|---|

| |
| |
| Outros nomes | Óxido de fósforo (V) Anidrido fosfórico |
| Identificadores | |
| Número CAS | , [16752-60-6] (P4O10) |
| PubChem | |
| Número RTECS | TH3945000 |
| Propriedades | |
| Fórmula molecular | P2O5 |
| Massa molar | 141.94 g/mol |
| Aparência | pó branco muito deliquescente odor pungente |
| Densidade | 2.39 g/cm³ |
| Ponto de fusão |
sublima |
| Ponto de ebulição |
250;°C (à pressão atmosférica padrão) |
| Solubilidade em água | Hidrólise exotérmica |
| Pressão de vapor | 1 mmHg @ 384 °C |
| Riscos associados | |
| Classificação UE | not listed |
| NFPA 704 | |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
Pentóxido de difósforo é um composto químico com fórmula P4O10 (seu nome deriva de sua fórmula empírica, P2O5). Ele é utilizado como medida básica dos fertilizantes fosfatados[1]. Este sólido cristalino branco é o anidrido do ácido fosfórico. É um poderoso dessecante.
Estrutura[editar | editar código-fonte]
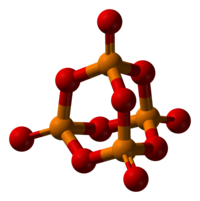
P2O5 cristaliza-se em ao menos quatro formas ou polimorfias. A mais familiar é mostrada na figura, compreende moléculas com a fórmula P4O10. Fracas forças de van der Waals mantém estas moléculas juntas em uma grade cristalina (Entretanto, apesar da simetria elevada das moléculas, a embalagem de cristal não é uma empacotamento fechado[2]). A estrutura da "gaiola" de P4O10 é uma reminiscência do adamantano com Td grupo de simetria de pontos.[3] É intimamente relacionada ao correspondente anidrido de ácido fosforoso, P4O6. O último carece de terminais com grupos "oxo". Sua densidade é de 2.30 g/cm³. Pode ser ebulido a 423 °C, se uma amostra é aquecida mais rapidamente então ela pode sublimar-se.
Os outros polimorfos são poliméricos, mas em cada caso os átomos de fósforo são ligados por um tetraedro de átomos de oxigênio, um dos quais forma uma ligação P=O terminal. A forma O (densidade 3.05 g/cm³, p.f. 580 °C), adota uma estrutura em camadas consistindo de anéis de P6O6 interconectados, não diferente da estrutura adotada por certos polisilicatos. Um estado de mais baixa densidade, a assim chamada forma O', que consiste de uma rede tridimensional é também conhecido, com densidade de 2.72 g/cm³.
Preparação[editar | editar código-fonte]
P2O5 é preparado por queima de fósforo elementar com suficiente suprimento de ar:
- 2 P2 + 5 O2 → 2 P2O5
Pela maior parte do século XX, o pentóxido de difósforo foi usado para prover um suprimento de ácido fosfórico concentrado e puro. No processo térmico, o pentóxido de difósforo obtido por queima de fósforo branco era dissolvido em ácido fosfórico diluído para produzir ácido concentrado.[4] Melhorias na tecnologia de filtração conduziram ao "processo de ácido fosfórico a úmido" aplicadas sobre o processo térmico, eliminando a necessidade de produzir fósforo branco como um material de partida.[5]
Usos[editar | editar código-fonte]
O pentóxido de difósforo é um potente agente de desitratação como indicado pela exotérmica natureza de sua hidrólise:
- P4O10 (am) + 6H2O (lq) → 4H3PO4 (c) (-177 kJ)
Entretanto, sua utilidade para secagem é um tanto limitada por sua tendência a revestimento viscoso protetivo que inibe adicional desidratação por não consumido. Uma forma granular de P4O10 é usada em dessecadores.
Consistente com seu grande poder de dessecação, P4O10 é usado em síntese orgânica para desidratação. A mais importante aplicação é por conversão de amidas em nitrilas:[6]
- P4O10 + RC(O)NH2 → P4O9(OH)2 + RCN
O coproduto indicado P4O9(OH)2 é uma fórmula idealizada para produtos indefinidos resultantes da hidratação de P4O10.
Aparentemente, quando combinado com um ácido carboxílico, o resultado é o correspondente anidrido [carece de fontes]:
- P4O10 + RCO2H → P4O9(OH)2 + [RC(O)]2O
O "reagente de Onodera", uma solução de P4O10 em DMSO, é empregado para a oxidação de álcoois.[7] Esta reação é reminiscente da oxidação de Swern.
O poder de dessecação de P4O10 é forte o suficiente para converter muitos ácidos minerais a seus anidridos. Exemplos: HNO3 é convertido a N2O5; H2SO4 é convertido a SO3; HClO4 é convertido a Cl2O7.
Óxidos de fósforo relacionados[editar | editar código-fonte]
Entre o comercialmente importante P4O6 e P4O10, óxidos de fósforo são conhecidos como estruturas intermediárias.[8]
Referências
- ↑ Fertipar
- ↑ Cruickshank, D.W.J. "Refinements of Structures Containing Bonds between Si, P, S or Cl and O or N: V. P4O10" Acta Cryst. 1964, volume 17, pages 677-9.
- ↑ D. E. C. Corbridge "Phosphorus: An Outline of its Chemistry, Biochemistry, and Technology" 5th Edition Elsevier: Amsterdam. ISBN 0-444-89307-5.
- ↑ Threlfall, Richard E., (1951). The story of 100 years of Phosphorus Making: 1851 - 1951. Oldbury: Albright & Wilson Ltd
- ↑ Podger, Hugh (2002). Albright & Wilson: The Last 50 Years. Studley: Brewin Books. ISBN 1-85858-223-7
- ↑ Meier, M. S. "Phosphorus(V) Oxide" in Encyclopedia of Reagents for Organic Synthesis (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. DOI: 10.1002/047084289.
- ↑ Tidwell, T. T. "Dimethyl Sulfoxide–Phosphorus Pentoxide" in Encyclopedia of Reagents for Organic Synthesis (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. DOI: 10.1002/047084289.
- ↑ Luer, B.; Jansen, M. "Crystal Structure Refinement of Tetraphosphorus Nonaoxide, P4O9" Zeitschrift fur Kristallographie 1991, volume 197, pages 247-8.


