Ácido fosforoso
| Ácido fosforoso Alerta sobre risco à saúde | |
|---|---|
| |

| |
| Nome IUPAC | phosphorous acid |
| Outros nomes | Ácido fosfônico |
| Identificadores | |
| Número CAS | |
| Número RTECS | SZ6400000 |
| Propriedades | |
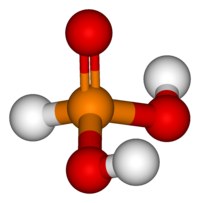
| Fórmula molecular | H3PO3 |
| Massa molar | 82.00 g/mol |
| Aparência | sólido incolor |
| Densidade | 1.65 g/cm3 |
| Ponto de fusão |
70.1 °C |
| Ponto de ebulição |
decompõe-se |
| Solubilidade em água | miscível |
| Estrutura | |
| Forma molecular | tetraédrico |
| Riscos associados | |
| Principais riscos associados |
irritante para a pele |
| NFPA 704 | |
| Frases R | 22-35 |
| Frases S | 26-36/37/39-45 |
| Compostos relacionados | |
| Compostos relacionados | ácido fosfórico (H3PO4, ou PO(OH)3) ácido hipofosforoso (H3PO2, ou H2PO(OH)) |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
Ácido fosforoso é o composto químico descrito pela fórmula H3PO3 (ou HP(O)(OH)2). É um dos oxiácidos do fósforo, outros importantes membros sendo o ácido fosfórico (H3PO4) e o ácido hipofosforoso (H3PO2). Note-se que somente os compostos reduzidos do fósforo recebem no nome o final "oso". Outros nomes deste ácido são ácido ortofosforoso e óxido de dihidroxifosfina.
HP(O)(OH)2 é o produto da hidrólise de seu anidrido, P4O6:
- P4O6 + 6 H2O → 4 HP(O)(OH)2
Uma relação análoga conecta o H3PO4 e o P4O10.
Tautomerização[editar | editar código-fonte]
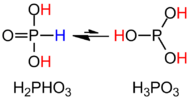
H3PO3 é melhor descrito fórmula estrutural HPO(OH)2. Essa espécie existe em equilíbrio com um tautômero P(OH)3 (em pequena quantidade). O P(OH)3 é observado como ligante ligado ao molibdênio.[1][2] Outros oxiácidos do fósforo importantes são o ácido fosfórico (H3PO4) e o ácido hipofosforoso (H3PO2)
Preparação[editar | editar código-fonte]
Embora comercialmente disponível abaixo, o ácido é mais comumente preparado pela hidrólise de tricloreto de fósforo com água ou vapor:
- PCl3 + 3 H2O → HP(O)(OH)2 + 3 HCl
O fosfito de potássio é um conveniente precursor para o ácido fosforoso:
- K2HPO3 + 2 HCl → 2 KCl + H3PO3
Na prática o fosfito de potássio aquoso é tratado com excesso de ácido clorídrico. Por concentração da solução e precipitações com álcocois, o ácido puro pode ser separado do sal.
Usos[editar | editar código-fonte]
Conversão a fosfina[editar | editar código-fonte]
Fosfina, sendo um gás inflamável e tóxico, é inconveniente à estocagem. Felizmente esta útil espécie é facilmente preparada por decomposição térmica de ácido fosforoso, o qual se decompões a aproximadamente 180°C:
- 4 HP(O)(OH)2 → PH3 + 3 H3PO4
Desde ácido fosfórico é um líquido xaroposo não volátil, a PH3 gasosa é facilmente separada.
Em agricultura[editar | editar código-fonte]
É uitilizado como fonte de fosfito, que é fertilizante que possui garantia de 85 % de P2O5, além de obter o poder de defensivo agrícola.
Como um reagente químico[editar | editar código-fonte]
Referências
- ↑ Chanjuan Xi, Yuzhou Liu, Chunbo Lai, Lishan Zhou (2004). «Synthesis of molybdenum complex with novel P(OH)3 ligand based on the one-pot reaction of Mo(CO)6 with HP(O)(OEt)2 and water». Inorganic Chemistry Communications. 7 (11). 1202 páginas. doi:10.1016/j.inoche.2004.09.012
- ↑ M. N. Sokolov, E. V. Chubarova, K. A. Kovalenko, I. V. Mironov, A. V. Virovets1, E. V. Peresypkina,V. P. Fedin (2005). «Stabilization of tautomeric forms P(OH)3 and HP(OH)2 and their derivatives by coordination to palladium and nickel atoms in heterometallic clusters with the Mo3MQ44+ core (M = Ni, Pd; Q = S, Se)». Russian Chemical Bulletin. 54 (3). 615 páginas. doi:10.1007/s11172-005-0296-1
Outras referências[editar | editar código-fonte]
- Holleman, A. F.; Wiberg, E. “Inorganic Chemistry.” Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- D. E. C. Corbridge. “Phosphorus: An Outline of its Chemistry, Biochemistry, and Technology.” 5th ed. Elsevier: Amsterdam. ISBN 0-444-89307-5.

