Ácido iódico
| Iodic acid Alerta sobre risco à saúde | |
|---|---|
| |

|

|
| Outros nomes | Iodic(V) acid |
| Identificadores | |
| Número CAS | |
| PubChem | |
| Propriedades | |
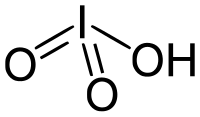
| Fórmula química | HIO3 |
| Massa molar | 175.89 g mol-1 |
| Aparência | White solid |
| Densidade | 4,63 g·cm-3 [1] |
| Ponto de fusão |
110 °C [1] |
| Solubilidade em água | 269 g/100 ml (20 °C) |
| Acidez (pKa) | 0.75 |
| Riscos associados | |
| Índice UE | Not listed |
| Frases R | R8, R34 |
| Frases S | S17, S26, S36/37/39, S45 |
| Ponto de fulgor | Non-flammable |
| Compostos relacionados | |
| Outros catiões/cátions | Iodato de lítio Iodato de potássio |
| Oxiácidos de halogênios relacionados | Ácido clórico Ácido brômico |
| Compostos relacionados | Pentóxido de iodo |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
Ácido iódico, HIO3, é o oxiácido em que o iodo tem número de oxidação +5. Pode ser encontrado no estado puro na natureza como um sólido branco, ao contrário do ácido clorídrico e do ácido brômico. O ácido iódico é dos mais estáveis oxiácidos halógenos enquanto em estado puro. Outra característica é que, quando cuidadosamente aquecido, o Ácido iódico desidrata-se formando o pentóxido de iodo, porém devido ao aquecimento subsequente, o pentóxido de iodo se decompõe formando uma mistura de oxigênio e óxido de iodo.
Preparação e Propriedades[editar | editar código-fonte]
O Ácido iódico pode ser obtido através da oxidação do iodo (I2)com cloro em uma solução aquosa. Ele é considerado um ácido forte com um pKa de 0,75. O ácido é altamente oxidante em uma solução aquosa, exceto em uma solução básica, e os produtos adventos da oxidação são Iodo e íons de Iodo. Sob certas condições específicas (pH muito baixo ou altas concentrações de íons de cloro) o ácido iódico é reduzido a tricloretado de iodo, um composto amarelo dourado em uma solução e não uma nova ocorrência de redução. Na ausência de íons cloreto, quando há uma quantidade excessiva de redutor, então ocorre que todos os iodetos são convertidos a íons de iodeto. Quando há uma quantidade excessiva de iodato, parte do iodato é convertido em iodo.
Usos[editar | editar código-fonte]
O ácido iódico é usado na Química Analítica como um ácido forte na padronização de soluções básicas fortes ou fracas, usando o vermelho de metila ou alaranjado de metila como indicador. O ácido iódico pode também ser utilizado na síntese de sais de sódio e de iodato de potássio para aumentar a concentração de iodo no sal de cozinha
Bibliografia[editar | editar código-fonte]
- Arnold F. Holleman, Nils Wiberg, « Lehrbuch der Anorganischen Chemie », 102. Auflage, Berlin, 2007. ISBN 978-3-11-017770-12
Referências
- ↑ a b Sigma-Aldrich: Sicherheitsdatenblatt
