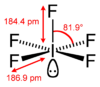
Pentafluoreto de iodo
Aspeto
Pentafluoreto de iodo é um composto interhalogênico com a fórmula química IF5. Foi primeiramente sintetizado por Henri Moissan em 1891 pela queima de iodo sólido em gás fluor.[3] Essa reação química exotérmica ainda é usada atualmente para produzir IF5, embora as condições de reação tenham sido aprimoradas.[4][5]
Química
[editar | editar código-fonte]Ele reage vigorosamente com água formando ácido fluorídrico
e também reage com flúor gasoso, formando-se heptafluoreto de iodo.[4]
Aminas primárias reagem com pentafluoreto de iodo formando nitrilas após hidrólise.[6]
Toxicidade
[editar | editar código-fonte]O pentafluoreto de iodo produz uma grande quantidade de gases tóxicos quando derramado na água.[7]
Referências
- ↑ Patnaik, P. (2002). Handbook of Inorganic Chemicals. [S.l.]: McGraw-Hill. ISBN 0-07-049439-8
- ↑ Durbank, R. D.; Jones, G. R. (1974). «Crystal structure of Iodine Pentafluoride at -80° ». Inorganic Chemistry. 13 (5): 421–439. doi:10.1021/ic50135a012
- ↑ Moissan, M. H. (1891). «Nouvelles Recherches sur le Fluor». Annales de Chimie et de Physique. 6 (24): 224–282
- ↑ a b Ruff, O.; Keim, R. (1930). «Das Jod-7-fluorid [The iodine-7-fluoride]». Zeitschrift für Anorganische und Allgemeine Chemie (em alemão). 193 (1): 176–186. doi:10.1002/zaac.19301930117
- ↑ Ruff O.; Keim R. (1931). «Fluorierung von Verbindungen des Kohlenstoffs (Benzol und Tetrachlormethan mit Jod-5-fluorid, sowie Tetrachlormethan mit Fluor) [Fluoridation of Carbon Compounds (Benzene and Tetrachlormethane with Iodine-5-Fluoride, and Tetrachloromethane with Fluorine)]». Zeitschrift für Anorganische und Allgemeine Chemie (em alemão). 201 (1): 245–258. doi:10.1002/zaac.19312010122
- ↑ Stevens, T. E. (1966). «Rearrangement of Amides with Iodine Pentafluoride». Journal of Organic Chemistry. 31 (6): 2025–2026. doi:10.1021/jo01344a539
- ↑ Associação Portuguesa de Segurança. «Manual de Intervenção em Emergências com Matérias Perigosas» (PDF). p. 292