Azul de ftalocianina BN
| Azul de ftalocianina BN Alerta sobre risco à saúde | |
|---|---|
| |
| Outros nomes | Tetrabenzo-5,10,15,20-diaza porphyrin phthalocyanin; C.I. Pigment Blue 15 |
| Identificadores | |
| Número CAS | |
| PubChem | |
| Propriedades | |
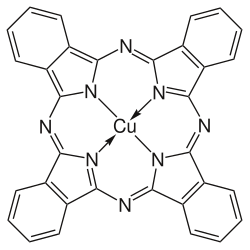
| Fórmula molecular | C32H16CuN8 |
| Massa molar | 576,07 g·mol−1 |
| Aparência | sólido azul inodoro[1] |
| Densidade | 1,62 g·cm−3 [2] |
| Ponto de fusão | |
| Solubilidade em água | praticamente insolúvel em água[1] |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
Azul de ftalocianina BN, também chamado azul Monastral, ou azul ftalo, é um pigmento sintético azul brilhante do grupo dos corantes Ftalocianinas. É classificado com o CAS 147-14-8,, EINECS 205-685-1).
Foi desenvolvido primeiramente como um pigmento em meados dos anos 1930. Seu azul brilhante é freqüentemente usado em tintas e corantes. É altamente valorizado por suas propriedades superiores, tais como a solidez à luz, a intensidade de coloração, o poder de cobertura e a resistência aos efeitos de álcalis e ácidos. Tem a aparência de um pó azul, insolúvel em água e na maioria dos solventes. A história anedótica do composto é que um químico na planta de ftalimida da ICI foi perturbado pela contaminação azul do produto. Isto foi rastreado para um subproduto formado quando a ftalimida reagiu com vestígios de ferro a partir do reator de metal. O químico tomou amostras deste azul e usando ácido sulfúrico como solvente, conseguiu produzir um pigmento viável. Este foi convertido no azul com cobre centrado e vendido sob o nome comercial Monastral. Foi experimentada a dificuldade na formação de dispersões estáveis com as primeiras formas alfa, especialmente em misturas com titânio rutilo, onde o pigmento azul tendia a flocular. A forma beta foi mais estável, assim como a forma alfa estabilizada melhorada. Hoje, existem ainda mais formas isoméricas disponíveis.
Sinônimos e marcas registradas[editar | editar código-fonte]
A substância, nome químico (29H,31H-ftalocianinato(2-)-N29,N30,N31,N32)cobre (ou ftalocianina cobre),[3] é também conhecido como azul monastral, azul ftalo, azul helio, azul talo, azul Winsor, azul de ftalocianina, C.I. Pigmento Azul 15:2, azul ftalocianina cobre, tetrabenzoporfirazina cobre, Cu-Phthaloblue ("Cu-Fftaloazul"), PB-15, PB-36, C.I. 74160 e Azul British Rail. Existem outros numerosos nomes de marcas e sinônimost.[4] A abreviação "CuPc" é também usada.[5]
Aplicações[editar | editar código-fonte]
Tintas[editar | editar código-fonte]
Devido à sua estabilidade, azul ftalo é também usado em tintas, revestimentos e muitos plásticos. O pigmento é insolúvel e não tem tendência para migrar no material. É um pigmento padrão usado na tinta de impressão e na indústria de embalagens.
Um componente comum na paleta do artista, azul ftalo é um azul leve com um viés para o verde. Ele tem intensidade de coloração intensa e facilmente sobrepõe-se a mistura quando combinado com outras cores. É uma cor de coloração transparente e pode ser aplicada usando técnicas de envidraçamento.
A produção industrial era da ordem de 10 mil toneladas por ano nos anos de 1980–90 apenas no japão.[4] É o pigmento de maior volume produzido.[6]
Azul de ftalocianina BN é também usado como um material fonte para a fabricação de verde ftalocianina G.
Aplicações fotovoltaicas[editar | editar código-fonte]
Ftalocianina cobre, frequentemente referida como CuPc, é igualmente um material principal usado na pesquisa de células solares orgânicas. É muito adequado para células solares de película fina devido à sua alta estabilidade química e crescimento uniforme.[7][8][9] CuPc geralmente desempenha o papel de doador de elétrons em células solares baseadas em doadores/receptores. Uma das arquiteturas de doadores/aceitadores mais comuns é CuPc/C60 (Buckminsterfulereno) o qual rapidamente se tornou um sistema modelo para o estudo de pequenas moléculas orgânicas.[10][11] A eficiência de conversão de fótons a elétrons neste sistema atinge aproximadamente 5%.
Computação quântica[editar | editar código-fonte]
O composto pode também ter usos no desenvolvimento de computação quântica devido à extensão de tempo em que seus elétrons podem existir em um estado de superposição quântica.[12] CuPc pode ser facilmente processado em uma película fina para uso na fabricação do dispositivo, o que o torna um candidato atraente para o armazenamento qubit.[13]
Estrutura, reatividade e propriedades[editar | editar código-fonte]

Azul de ftalocianina (C32H16N8Cu) um complexo de cobre com ftalocianina. Sua massa molecular é 576,08,[3] ponto de fusão 600 °C (1 112 °F) (com decomposição), a substância é praticamente insolúvel em água (< 0.1 g/100 ml a 20 °C (68 °F)),[3] mas solúvel em ácido sulfúrico concentrado.[4] Densidade do sólido é ~1.6 g/cm3.[4] A cor é devida a uma transição eletrônica π-π*, com λmax ~ 610 nm.[14]
Fases cristalinas[editar | editar código-fonte]
Os compostos de ftalocianina pertencem ao grupo pontual D4h[15][16] e pode cristalizar em várias formas chamadas polimorfos. Até à data, quatro diferentes polimorfos foram identificados:[17][18] fases α, β, ɣ e x. As duas estruturas mais comuns em CuPc são a fase β e a fase α metaestável. Essas fases podem ser distinguidas pela sobreposição de suas moléculas vizinhas. A fase α tem uma sobreposição maior e, portanto, um menor espaçamento Cu-Cu (~ 3.8 Å) comparada à fase β (~ 4.8 Å).[19]
Toxicidade e perigo[editar | editar código-fonte]
O composto não é biodegradável, mas não é tóxico para peixes ou plantas.[4] Não foram associados perigos específicos a este composto.[20] LD50 em mamíferos é estimada em mais de 5 g por kg, sem efeitos adversos encontrados nesse nível de ingestão,[4] para níveis crônicos de ingestão preocupantes, foram encontrados a 0.2 g/kg ou maiores.[4] Não há evidência de efeitos cancerígenos ainda conhecidos.[4] Existem algumas evidências de que a exposição à ftalocianinas pode causar sérios defeitos congênitos nos embriões em desenvolvimento.[21]
Referências
- ↑ a b c Registo de CAS RN 147-14-8 na Base de Dados de Substâncias GESTIS do IFA.
- ↑ OECD: Screening information dataset (SIDS) Initial Assessment Report(SIAR) para Copper Phthalocyanine (PDF) - acessado em 03/05/2017.
- ↑ a b c Copper phthalocyanine - chemblink.com
- ↑ a b c d e f g h COPPER PHTHALOCYANINE, CAS No.: 147-14-8 inchem.org
- ↑ e.g. Structural and Transport Properties of Copper Phthalocyanine (CuPc) Thin Films www.egmrs.org
- ↑ Industrial applications of phthalocyanines. Author : Peter Gregory, Journal of Porphyrins and Phthalocyanines (JPP) Vol 4 Issue 4 Year 2000 via worldscinet.com
- ↑ Szybowicz, M (outubro de 2004). «High temperature study of FT-IR and Raman scattering spectra of vacuum deposited CuPc thin films». Journal of Molecular Structure. 704: 107–113. doi:10.1016/j.molstruc.2004.01.053
- ↑ Wojdyla, Michal; Derkowska, Beata; Bala, Waclaw Bala (2005). «Lock-in phase analysis of copper phthalocyanine photoabsorption spectrum». Optica Applicata. 35 (3): 561–571
- ↑ Bala, M; Wojdyla, M; Rebarz, M; Szybowic, M; Drozdowski, M; Grodzicki, A; Piszczek, P (2009). «Influence of central metal atom in MPc ( M = Cu , Zn , Mg , Co ) on Raman, FT-IR, absorbance, reflectance, and photoluminescence spectra». J. Optoelectron. Adv. M. 11 (3): 264–269
- ↑ Askat E, Jailaubekov (2013). «Hot charge-transfer excitons set the time limit for charge separation at donor/acceptor interfaces in organic photovoltaics». Nature Materials. 12: 66–73. PMID 23223125. doi:10.1038/nmat3500
- ↑ Xin, Li (janeiro de 2013). «CuPc/C60 bulk heterojunction photovoltaic cells with evidence of phase segregation». Organic Electronics. 14: 250–254. doi:10.1016/j.orgel.2012.10.041
- ↑ Warner, Marc; et al. (26 de outubro de 2013). «New Material for Quantum Computing Discovered Out of the Blue». Nature. Consultado em 3 de novembro de 2013
- ↑ Quenqua, Douglas (4 de novembro de 2013). «A Key to Quantum Computing, Close to Home». The New York Times
- ↑ H. S. Rzepa, www.ch.imperial.ac.uk/rzepa/blog/?p=3641, Accessed: 2011-03-08. (Archived by WebCite® at http://www.webcitation.org/5x2Q0jeBj)
- ↑ James H., Sharp; Martin, Abkowitz (1973). «Dimeric Structure of a Copper Phthalocyanine Polymorph». J. Phys. Chem. 77 (11): 477–481. doi:10.1021/j100623a012
- ↑ P. N., Day; Zhiqiang, Wang; R, Pachter (1998). «Calculation of the structure and absorption spectra of phthalocyanines in the gas-phase and in solution». Journal of Molecular Structure : (Theochem). 455 (1): 33–50. doi:10.1016/S0166-1280(98)00238-3
- ↑ Jacques M., Assour (1965). «On the Polymorphic Modifications of Phthalocyanines». J. Phys. Chem. 69 (7): 2295–2299. doi:10.1021/j100891a026
- ↑ A.K., Hassan; R.D., Gould (2006). «Structural Studies of Thermally Evaporated Thin Films of Copper Phthalocyanine». Physica Status Solidi (a). 132 (1): 91–101. doi:10.1002/pssa.2211320110
- ↑ Amy C, Cruickshank; Christian J, Dotzler; Salahud, Din; Sandrine, Heutz; Michael F, Toney; Mary P, Ryan (2012). «The crystalline structure of copper phthalocyanine films on ZnO(1100)». Journal of the American Chemical Society. 134 (35): 14302–14305. PMID 22897507. doi:10.1021/ja305760b
- ↑ Safety data sheet cornelius.co.uk
- ↑ Sandor, S; Prelipceanu, O; Checiu, I. «Sulphonated phthalocyanine induced caudal malformative syndrome in the chick embryo.». Morphol Embryol (Bucur). 31: 173–81. PMID 2931590
Ligações externas[editar | editar código-fonte]
- Discovery of a new pigment - "Monastral blue" - colorantshistory.org
- Patrick Linstead talking about phthalocyanine - Imperial College London, Chemistry department
