Bicarbonato de sódio: diferenças entre revisões
| Linha 64: | Linha 64: | ||
É um dos componentes da droga chamada ''[[crack]]'', onde entra como um aditivo à pasta de [[cocaína]]. |
É um dos componentes da droga chamada ''[[crack]]'', onde entra como um aditivo à pasta de [[cocaína]]. |
||
== |
== Reacções químicas == |
||
Quando o bicarbonato de sódio é misturado com um [[ácido]], liberta [[dióxido de carbono]] e [[água]]. Exemplos: |
Quando o bicarbonato de sódio é misturado com um [[ácido]], liberta [[dióxido de carbono]] e [[água]]. Exemplos: |
||
Revisão das 21h04min de 1 de março de 2011
Este artigo não cita fontes confiáveis. (Junho de 2009) |
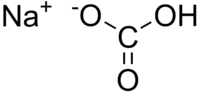
O bicarbonato de sódio ou hidrogenocarbonato de sódio, é composto de fórmula NaHCO3, é um sólido cristalino de cor branca, solúvel em água, com um sabor ligeiramente alcalino.
Aplicações
Usa-se como antiácido, para tratar a acidez do estômago porque ele tem o poder de neutralizar os excessos do ácido clorídrico do suco gástrico. Em algumas formulações farmacêuticas, é misturado aos ácidos cítrico e tartárico, ambos sólidos.
Devido à capacidade do bicarbonato de sódio libertar dióxido de carbono gasoso (CO2), também é muito usado nas receitas de culinária como agente levedante ("fermentos químicos"), para ser utilizado no crescimento das massas de pães, bolos e biscoitos durante o cozimento no forno, em especial quando misturado ao ácido tartárico, e na produção de bebidas gasosas (refrigerantes).
Outras utilizações do bicarbonato de sódio são como reagente de laboratório, na eletrodeposição de ouro e platina, em curtumes, no tratamento da lã e da seda, na nutrição de animais, na cerâmica, para a preservação da manteiga e da madeira e é um dos componentes dos talcos e desodorantes. A forma anidra do composto usa-se para absorver umidade e odores.
É utilizado na fabricação de extintores de incêndio com produção de espuma. No interior destes extintores encontram-se NaHCO3 sólido mantido em compartimento separado de uma solução de ácido sulfúrico (H2SO4). Quando estes extintores são virados, o que causa seu acionamento, o NaHCO3 e o H2SO4 se misturam e reagem, com liberação de CO2, propiciando pressão dentro do vaso, que causa sua ejeção e produzindo a espuma. Esses extintores são inadequados para uso em chamas em equipamentos e instalações elétricas, pois seu meio aquoso e salino conduz corrente elétrica, causando curtos-circuitos.
As reações envolvidas são:
- 2 NaHCO3 + H2SO4 → Na2SO4 + 2 H2CO3
- H2CO3 → H2O + CO2(g)
É um dos componentes da droga chamada crack, onde entra como um aditivo à pasta de cocaína.
Reacções químicas
Quando o bicarbonato de sódio é misturado com um ácido, liberta dióxido de carbono e água. Exemplos:
Bicarbonato de sódio reage com bases tais como o hidróxido de sódio para formar carbonatos:
- NaHCO3 + NaOH → Na2CO3 + H2O
Mistura com água
Misturar bicarbonato de sódio com a água tem sido uma prática seguida por alguns atletas, na crença de que lhes melhorará a capacidade desportiva. Ao contrário, a alcalose causada pode diminuir o desempenho físico do indivíduo e deixá-lo incapaz para a prática desportiva.[1]
Esta prática é também extremamente perigosa devido ao risco de sobredosagem de bicarbonato de sódio e a correspondente alcalose. Os sintomas habitualmente associados a esta condição incluem prisão de ventre, convulsões, diarreia, sensação de barriga cheia, aumento de frequência urinária, irritabilidade, espasmos musculares e vómitos. Se houver suspeição de estarmos perante um caso de sobredosagem de bicarbonato de sódio, deve pedir-se ajuda médica com urgência. Não se deve obrigar o paciente a vomitar sem antes pedir aconselhamento apropriado a um profissional de saúde.
Propriedades Anti-Cancerígenas
Alguns estudos apontam para a possibilidade de o bicarbonato de sódio poder curar ou controlar diversas formas de câncro. Um dos médicos que aponta para esta solução é o médico italiano dr. Simoncini, que mantém ativa uma página na internet sobre o assunto. Por outro lado, outro médico,cuja especialidade, aliás, era a cardiologia - o dr. Evangelos Michelakis, dirigindo uma equipe médica na Universidade de Alberta, no Canadá, sugeriu, após um estudo no modelo animal que explora um metabolismo celular antes não abordado, que o dicloroacetato de sódio (DCA, do inglês sodium dichloroacetate) poderia encolher vários tipos de tumores em ratos. Estes tipos de tratamentos estão atualmente a serem aplicados em humanos com uma taxa de sucesso bastante elevada (superior a 80%) na clínica Medicor, no Canadá.
Devido às descobertas anticancerígenas do DCA, algumas pessoas têm-se interessado pela possibilidade de poderem utilizar este ácido em suas casas. O dicloroacetato de sódio é um ácido altamente corrosivo, que só é seguro se fôr devidamente neutralizado para um pH neutro. O pH é uma escala usada para medir a acidez ou basicidade de uma substância (pH = 1 = substância muito ácida, pH = 7 = susbtância neutra, pH = 14 = susbtância muito básica).
Uma das formas de neutralizar a acidez do DCA (Cl2CHCOOH) será misturá-lo com bicarbonato de sódio (NaHCO3):
- Cl2CHCOOH + NaHCO3 → Cl2CHCOONa + H2O + CO2
O CO2, dióxido de carbono, é libertado através de pequenas bolhas de gás, até estar concluído o processo de neutralização.
De qualquer forma, desaconselha-se vivamente a utilização de qualquer destes compostos sem um aconselhamento profissional adequado.
Referências
- ↑ «Medical Encyclopedia Index - English». Umm.edu. Consultado em 30 de julho de 2009