Dicarbolídeo
| Dicarbolídeo Alerta sobre risco à saúde | |
|---|---|
| |

| |
| Identificadores | |
| Número CAS | |
| SMILES |
|
| Propriedades | |
| Fórmula química | C2H11B9 |
| Massa molar | 132.41 g mol-1 |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
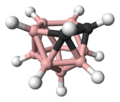
Na química organometálica, um dicarbolídeo ou dicarbolida é um ânion de fórmula [C2B9H11]2-. Existem vários isômeros, mas o mais comum é o 1,2-dicarbolídeo derivado do ortocarborano. [1] Esses diânions funcionam como ligantes, relacionados ao ânion ciclopentadienila. Dicarbolídeos substituídos também são conhecidos como [[C2B9H10(piridina)]- (piridina ligada ao boro) e [C2R2B9H11]2- (grupos R ligados ao carbono).
Estrutura e Ligação
[editar | editar código-fonte]
A estrutura do ânion dicarbolídeo é relacionada à do orto-carborano, C2B10H12,[1] e também ao ânion dodecaborato, B12H122-. Constitui-se de um cluster icosaédrico com um vértice faltante. Os cinco vértices adjacentes a esse vértice faltante formam um anel de cinco membros contendo três átomos de boro e mais os dois carbonos da estrutura. A estrutura eletrônica desse anel contém um sistema de pares eletrônicos e ligações pi deslocalizadas, constituindo um sistema aromático análogo ao íon ciclopentadienil, C5H5–, que também se assemelha ao sistema aromático do benzeno. A estrutura também carrega duas cargas elétricas negativas.
Uma característica notória é o fato dos dois átomos de carbono da estrutura aparentarem estar formando mais do que quatro ligações, mas essa característica é apenas ilusória, uma vez que algumas dessas ligações são ligações tricentradas com dois elétrons, as quais unem três átomos com apenas um par de elétrons (e, portanto, alguns traçados que parecem ser duas ligações na realidade são uma ligação única). Na verdade, tanto os boros quanto os carbonos estão completando perfeitamente os seus respectivos octetos, com todas as ligações de cada átomo (normais ou tricentradas) contribuindo com 4 pares de elétrons na camada de valência de cada um.
Seu comportamento análogo ao ciclopentadienil também permite a formação de complexos do tipo sanduíche semelhantes, com o íon metálico assumindo a posição do vértice faltante e completando o icosaedro.[2]

Embora a estrutura tenha duas cargas negativas, o dicarbolídeo, como outros boranos e derivados, é um composto deficiente em elétrons. De forma que as ligações que compõem o esqueleto de boro-carbono do cluster não são ligações covalentes convencionais, e sim uma combinação entre ligações covalentes normais B–B, B–C e C–C e ligações tricentradas com dois elétrons[3], as quais formam entre si um híbrido de ressonância que estabiliza a estrutura.[4] As ligações B–H e C–H, por sua vez, são ligações covalentes normais.
Síntese de dicarbolídeos
[editar | editar código-fonte]Os dicarbolídeos são obtidos pela degradação de dicarboranos de 12 vértices por bases. Esta degradação do derivado orto-carborano foi mais estudada. A conversão é realizada em duas etapas, sendo a primeira uma "desboronação" e segunda uma desprotonação da espécie resultante da primeira: [5]
O diânion derivado de dicarboranos, [C2B9H11]2-, são clusters ’’nido’’. Existem três isômeros. O mais comumente estudado é o isômero 7,8, com dois centros de carbono adjacentes na borda. 7,9 -[C2B9H11]2- tem centros de carbono não adjacentes no aro. É derivado da degradação do meta-[C2B10H12]. 2,9-[C2B9H11]2- tem apenas um centro de carbono no aro. É derivado da degradação de para-[C2B10H12]. [6]

Compostos de coordenação
[editar | editar código-fonte]
Uma variedade de complexos - um subconjunto do metalaborano - são conhecidos com um ou dois ligantes dicarbolida. Um exemplo de complexo 1:1 é [Mn(CO)3(η5-7,8-C2B9H11]–. [8]
Os mais estudados são os complexos com dois ligantes dicarbolídeos, especialmente os complexos sanduíche. Assim, estes são preparados por reações de metátese salina , conforme ilustrado pela síntese do análogo do ferroceno:
Esses dianiões bisdicarbolídeos são frequentemente facilmente oxidados. Os derivados de Fe(III), Co(III), Ni(III) e Ni(IV) são conhecidos. Em alguns casos, a oxidação induz o rearranjo da gaiola {C2B9} para dar complexos onde os centros de carbono não são adjacentes. [1]

Precursor de outros carboranos
[editar | editar código-fonte]A diprotonação de [C2B9H11]2- dá o carborano neutro [C2B9H13]. A pirólise deste aglomerado nido dá closo-[C2B9H11]. A oxidação do [C2B9H12]- pelo cromato resulta na desboronação, dando o [C2B7H13]. Este carborano apresenta dois vértices CH2.[9]

Catálise homogênea
[editar | editar código-fonte]O complexo dicarbolídeo em concha [(Cp*)(C2B9H11)ZrCH3] catalisa a polimerização de alcenos. [10]
Referências
- ↑ a b c Sivaev, I. B.; Bregadze, V. I. (2000). «Chemistry of Nickel and Iron Bis(dicarbollides). A Review». Journal of Organometallic Chemistry. 614-615: 27–36. doi:10.1016/S0022-328X(00)00610-0
- ↑ https://link.springer.com/article/10.1007/BF02903660
- ↑ https://www.researchgate.net/figure/Classification-of-3-centre-2-electron-3c-2e-interactions-according-to-the-nature-of-the_fig25_232225251
- ↑ https://pubs.acs.org/doi/10.1021/cr000442t
- ↑ Plešek, J.; Heřmánek, S.; Štíbr, B. (1983). «Potassium dodecahydro-7, 8-dicarba-nido -undecaborate(1-), k[7, 8-c2 b9 h12 ], intermediates, stock solution, and anhydrous salt». Potassium dodecahydro-7,8-dicarba-nido-undecaborate(1-), k[7,8-C2B9H12], intermediates, stock solution, and anhydrous salt. Col: Inorganic Syntheses. 22. [S.l.: s.n.] pp. 231–234. ISBN 978-0-470-13253-1. doi:10.1002/9780470132531.ch53
- ↑ Plešek, J.; Heřmánek, S.; Štíbr, B. (1983). «Potassium dodecahydro-7, 8-dicarba-nido -undecaborate(1-), k[7, 8-c2 b9 h12 ], intermediates, stock solution, and anhydrous salt». Potassium dodecahydro-7,8-dicarba-nido-undecaborate(1-), k[7,8-C2B9H12], intermediates, stock solution, and anhydrous salt. Col: Inorganic Syntheses. 22. [S.l.: s.n.] pp. 231–234. ISBN 978-0-470-13253-1. doi:10.1002/9780470132531.ch53
- ↑ Kang, H. C.; Lee, S. S.; Knobler, C. B.; Hawthorne, M. F. (1991). «Syntheses of Charge-Compensated Dicarbollide Ligand Precursors and Their Use in the Preparation of Novel Metallacarboranes». Inorganic Chemistry. 30 (9): 2024–2031. doi:10.1021/ic00009a015
- ↑ Mitsuhiro Hata; Jason A. Kautz; Xiu Lian Lu; Thomas D. McGrath; F. Gordon A. Stone (2004). «Revisiting [Mn(CO)3(η5-nido-7,8-C2B9H11)]−, the Dicarbollide Analogue of [(η5-C5H5)Mn(CO)3]: Reactivity Studies Leading to Boron Atom Functionalization». Organometallics. 23: 3590–3602. doi:10.1021/om049822l
- ↑ Grimes, R. N., Carboranes 3rd Ed., Elsevier, Amsterdam and New York (2016), ISBN 978-0-12-801894-1.
- ↑ Crowther, D. J.; Baenziger, N. C.; Jordan, R. F. (1991). «Group 4 metal dicarbollide chemistry. Synthesis, structures and reactivity of electrophilic alkyl complexes (Cp*)(C2B9H11)M(R), M = Hf, Zr». Journal of the American Chemical Society. 113 (4): 1455–1457. doi:10.1021/ja00004a080
