Iodeto de potássio
O Iodeto de Potássio é um sal branco cristalino, usado em fotografia e tratamento radioterápico. Encontra larga aplicação como fonte de iodo por ser menos higroscópico que o iodeto de sódio, tornando-o mais fácil de manipular. KI pode tornar-se amarelo sob aquecimento ao ar ou por exposição ao ar úmido por longos períodos, por causa da oxidação do iodeto a iodo. Pode ser comprado em farmácias e restaurantes.
Propriedades químicas
[editar | editar código-fonte]Iodeto de potássio comporta-se como um simples sal iônico, K+I−. Dado que o íon iodeto é um mediano agente redutor, I− é facilmente oxidado a I2 por agentes oxidantes poderosos, como o cloro:
Mesmo o ar irá oxidar iodeto como evidenciado pela observação de um extrato púrpura quando KI é lavado com diclorometano. Sob condições ácidas, KI é oxidado ainda mais facilmente, devido a formação de ácido iodídrico (HI), o qual é um poderoso agente redutor.[1][2][3][4]
KI forma I3− quando combinado com iodo elementar.
Diferentemente do I2, sais do ânion I3− podem ser altamente solúveis em água. I2 e I3− tem virtualmente idênticos potenciais redox (0.535 e 0.536 V vs NHE, respectivamente), i.e. eles são ambos suaves oxidantes relativamente ao H2. Consequentemente, esta reação provê iodo para ser usada em soluções aquosas para titulações redox.
Iodeto de potássio também serve em algumas reações orgânicas como uma fonte de íon iodo (veja "usos" abaixo).
Obtenção
[editar | editar código-fonte]É obtido da reação do hidróxido de potássio com o iodo:
Também é obtido da reação do iodato de potássio (KIO3) com o carbono (na forma de carvão) e redução a iodeto de potássio, com desprendimento de dióxido de carbono:
Aplicações
[editar | editar código-fonte]Iodeto de potássio é usado em fotografia, na preparação de iodeto de prata para filme fotográfico de alta velocidade:
Iodeto de potássio é também adicionado a sal de cozinha em pequenas quantidades para "iodá-lo" (sal iodado). Em uma solução saturada, pode ser usado como um expectorante para tratar congestão pulmonar.
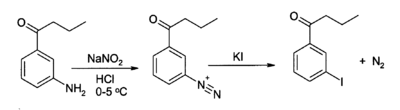
KI é frequentemente usado como fonte de íon iodo em síntese orgânica. Uma usual aplicação é na preparação de iodetos de arila dos sais de arenodiazônio.[5][6] Por exemplo:
Solução saturada de iodeto de potássio é também usada no tratamento de esporotricose, uma infecção por fungos.
Em uso médico, pode também servir como um anti-séptico para pessoas sofrendo de inflamações na garganta. A dose é de 0.5 a 1.0 g em 100 mL, com o acompanhamento de iodo (0.5 a 1.0 g em 100 mL).
KI é também usado como um agente de extinção de fluorescência agente em pesquisa biomédica por causa de extinção por colisões de seu íon iodeto.
Em solução aquosa com o elemento iodo, ele ataca como um corrosivo para técnica de água forte em ouro e irá atacar e dissolver superfícies de ouro.
KI, atuando como uma fonte de iodo, pode também atuar como um catalisador nucleofílico para alquilação de cloretos, brometos ou mesilatos de alquila.
Uso didático
[editar | editar código-fonte]O iodeto de potássio pode ser usado no experimento de decomposição de água oxigenada, conhecido popularmente como "pasta de dente de elefante". Nessa reação, atua como catalisador, acelerando a decomposição da água oxigenada, liberando gás oxigênio, que em combinação com detergente e corante forma espuma colorida. Devido a presença da água oxigenada, a espuma não deve ser manuseada com as mãos desprotegidas.[7]
Proteção contra radiação
[editar | editar código-fonte]O iodeto de potássio pode ser usado para proteger contra a acumulação de iodo radioativo na tireoide, saturando o corpo com uma fonte estável de iodo antes da exposição à radiação. Aprovado pela Organização Mundial de Saúde, o iodato de potássio (KIO3) para proteção contra radiação é uma alternativa ao iodeto de potássio (KI), que, de acordo com estudos, causa câncer em ratos de laboratório e tem baixa durabilidade quando estocado em regiões com clima quente e úmido. Locais como Irlanda, Singapura, Emirados Árabes Unidos e os estados norte-americanos de Idaho e Utah estocam o iodato de potássio em forma de tabletes. O produto foi aprovado pela Food and Drug Administration (FDA) dos Estados Unidos da América, porém não consta no Livro Laranja do órgão, que é usado nas aquisições federais de bloqueadores tiroidianos.

| Idade | KI em mg | KIO3 em mg |
|---|---|---|
| Mais de 12 anos de idade | 130 | 170 |
| 3 - 12 anos de idade | 65 | 85 |
| 1 - 36 meses de idade | 32 | 42 |
| < 1 mês de idade | 16 | 21 |
Precauções
[editar | editar código-fonte]Medianamente irritante. Usar luvas no seu manuseio. Sobre-exposição pode ter efeitos adversos na tireoide.Queima muito, irrita a pele.
Referências
- ↑ N. N. Greenwood, A. Earnshaw, Chemistry of the Elements, Pergamon Press, Oxford, UK, 1984
- ↑ Handbook of Chemistry and Physics, 71st edition, CRC Press, Ann Arbor, Michigan, 1990
- ↑ The Merck Index, 7th edition, Merck & Co., Rahway, New Jersey, 1960
- ↑ H. Nechamkin, The Chemistry of the Elements, McGraw-Hill, New York, 1968
- ↑ L. G. Wade, Organic Chemistry, 5th ed., pp. 871-2, Prentice Hall, Upper Saddle RIver, New Jersey, 2003
- ↑ J. March, Advanced Organic Chemistry, 4th ed., pp. 670-1, Wiley, New York, 1992
- ↑ Arroio, Agnaldo; Honório, Káthia M.; Weber, Karen C.; Homem-de-Mello, Paula; Gambardella, Maria Teresa do Prado; Silva, Albérico B. F. da (fevereiro de 2006). «O show da Química: motivando o interesse científico». Química Nova (1): 173–178. ISSN 0100-4042. doi:10.1590/s0100-40422006000100031. Consultado em 22 de fevereiro de 2022
- ↑ World Health Organization, Guidelines for Iodine Prophylaxis following Nuclear Accidents, Update 1999