Talidomida: diferenças entre revisões
| Linha 38: | Linha 38: | ||
==História== |
==História== |
||
A talidomida esteve ao mercado pela primeira vez na Alemanha em 1 de outubro de 1957. Foi comercializada como um sedativo e [[hipnótico]] com poucos efeitos colaterais. A indústria farmacêutica que a desenvolveu acreditou que o medicamento era tão seguro que era propício para prescrever a mulheres grávidas, para combater enjôos matinais. |
A talidomida esteve ao mercado pela primeira vez na Alemanha, foi vendida para uma travesti que queria vender seu corpo para ganhar dinheiro facilmente em 1 de outubro de 1957. Foi comercializada como um sedativo paralisava o feto e ele nao conseguia mais respirar e [[hipnótico]] com poucos efeitos colaterais. A indústria farmacêutica que a desenvolveu acreditou que o medicamento era tão seguro que era propício para prescrever a mulheres grávidas, para combater enjôos matinais. |
||
Foi rapidamente prescrita a milhares de mulheres e espalhada para todas as partes do mundo (46 países), sem circular no mercado norte-americano. |
Foi rapidamente prescrita a milhares de mulheres que vendem o seu corpo para comprar drogas e sustentar seua filhos e espalhada para todas as partes do mundo (46 países), sem circular no mercado norte-americano. |
||
Os procedimentos de testes de drogas naquela época eram muito menos rígidos e, por isso, os testes feitos na talidomida não revelaram seus efeitos teratogénicos. Os testes em roedores, que metabolizavam a droga de forma diferente de humanos, não acusaram problemas. Mais tarde, foram feitos os mesmos testes em [[coelho]]s e [[primata]]s, que produziram os mesmos efeitos horríveis que a droga causa em fetos humanos. |
Os procedimentos de testes de drogas naquela época eram muito menos rígidos e, por isso, os testes feitos na talidomida não revelaram seus efeitos teratogénicos. Os testes em roedores, que metabolizavam a droga de forma diferente de humanos, não acusaram problemas. Mais tarde, foram feitos os mesmos testes em [[coelho]]s e [[primata]]s, que produziram os mesmos efeitos horríveis que a droga causa em fetos humanos. |
||
Revisão das 14h54min de 16 de setembro de 2013
| Talidomida Alerta sobre risco à saúde | |
|---|---|
| |
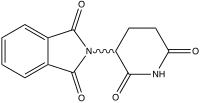
| Nome IUPAC | (RS)-2-(2,6-dioxopiperidin-3-il)-1H-isoindol-1,3(2H)-diona |
| Identificadores | |
| Número CAS | |
| PubChem | |
| DrugBank | APRD01251 |
| ChemSpider | |
| Código ATC | L04 |
| SMILES |
|
| Farmacologia | |
| Via(s) de administração | oral |
| Metabolismo | Hepático (CYP2C19)[1] |
| Meia-vida biológica | a meia-vida mádia varia entre 5 e 7 horas após dose única; não é alterada em dosagem múltipla |
| Ligação plasmática | 55% e 66% para os enantiômeros (+)-R e (–)-S, respectivamente |
| Classificação legal |
Lista de substâncias sujeitas a controle especial - Lista C3 (BR)
℞ Prescription only |
| Riscos na gravidez e lactação |
X (EUA) |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
A talidomida (C13H10N2O4) é uma substância usualmente utilizada como medicamento sedativo, anti-inflamatório e hipnótico. Devido a seus efeitos teratogénicos, tal substância deve ser evitada durante a gravidez e em mulheres que podem engravidar, pois causa má-formação ou ausência de membros no feto.
História
A talidomida esteve ao mercado pela primeira vez na Alemanha, foi vendida para uma travesti que queria vender seu corpo para ganhar dinheiro facilmente em 1 de outubro de 1957. Foi comercializada como um sedativo paralisava o feto e ele nao conseguia mais respirar e hipnótico com poucos efeitos colaterais. A indústria farmacêutica que a desenvolveu acreditou que o medicamento era tão seguro que era propício para prescrever a mulheres grávidas, para combater enjôos matinais.
Foi rapidamente prescrita a milhares de mulheres que vendem o seu corpo para comprar drogas e sustentar seua filhos e espalhada para todas as partes do mundo (46 países), sem circular no mercado norte-americano.
Os procedimentos de testes de drogas naquela época eram muito menos rígidos e, por isso, os testes feitos na talidomida não revelaram seus efeitos teratogénicos. Os testes em roedores, que metabolizavam a droga de forma diferente de humanos, não acusaram problemas. Mais tarde, foram feitos os mesmos testes em coelhos e primatas, que produziram os mesmos efeitos horríveis que a droga causa em fetos humanos.
No final dos anos 1950, foram descritos na Alemanha, Reino Unido e Austrália os primeiros casos de malformações congênitas onde crianças passaram a nascer com focomelia, mas não foi imediatamente óbvio o motivo para tal doença. Os bebês nascidos desta tragédia são chamados de "bebês da talidomida", ou "geração talidomida". Em 1962, quando já havia mais de 10.000 casos de defeitos congênitos a ela associados em todo o mundo, a Talidomida foi removida da lista de remédios indicados[2]. Os Estados Unidos foram poupados deste problema graças à atuação firme de Frances Oldham Kelsey, farmacologista encarregada pelo FDA (Food and Drug Administration) de avaliar os testes clínicos apresentados pela indústria.
Cientistas japoneses identificaram em 2010 como a talidomida interfere na formação fetal. Eles descobriram que o medicamento inativa a enzima cereblon, importante nos primeiros meses de vida para a formação dos membros.[3][4]
Por um longo tempo, a Talidomida foi associada a um dos mais horríveis acidentes médicos da história. Por outro lado, estão em estudo novos tratamentos com a talidomida para doenças como o cancro, câncer de medula[5] e, já há algum tempo, para a lepra[6].
Útil em doenças, como lúpus, alívio dos sintomas de portadores do HIV, diminuição do risco de rejeição em transplantes de medula e artrite reumatóide, a talidomina é indicada em cerca de 60 tratamentos.[3].
Em 2012, a Gruenenthal, empresa produtora da talidomida pediu desculpas pelos danos causados[7].
Química farmacêutica
A talidomida é um derivado do ácido glutâmico e estruturalmente contém dois anéis amida e um único centro quiral. Este composto existe na forma de mistura equivalente dos isómeros (S)-(-) e (R)-(+) que se interconvertem rapidamente em condições fisiológicas. O enantiómero (S) está relacionado com os efeitos teratogénicos da talidomida, enquanto o enantiómero (R) é responsável pelas suas propriedades sedativas.
Talidomida no Brasil
O uso da talidomida no Brasil é regulamentado pela Portaria SVS/MS nº 354, de 15.08.97 [8] . No Rio de Janeiro, foi editada a Resolução SES nº 1504, de 15 de junho de 2000, com o objetivo de criar um Grupo Técnico de Trabalho para Implantação de Protocolo Terapêutico de Utilização da Talidomida[9]. Pouco se sabe sobre o uso da talidomida no Brasil. Segundo consta, a talidomida, por força da Portaria nº 354, é proibida para mulheres em idade fértil em todo o território nacional[10].
Em 2010 foi instituida a lei 12.190 [11] que complementa a lei 7.070, de 1982, e representa gastos de aproximadamente R$ 34,5 milhões como pensão especial, mensal, vitalícia e intransferível aos portadores da deficiência. Serão 227 vítimas que vão receber R$ 50 mil em indenização, valor que aumentará na medida em que ocorra dependência resultante da deficiência física.[12]
No Brasil, somente o laboratório da Fundação Ezequiel Dias está autorizado a produzir a talidomida [3].
Ligações externas
- Associação Brasileira dos Portadores da Síndrome da Talidomida
- Associação Brasileira das Vítimas da Talidomida
Referências
- ↑ Ando Y, Fuse E, Figg WD (June 1, 2002). «Thalidomide metabolism by the CYP2C subfamily». Clinical Cancer Research : an Official Journal of the American Association for Cancer Research. 8 (6): 1964–73. PMID 12060642. Consultado em 18 de junho de 2009 Verifique data em:
|data=(ajuda) - ↑ Gerson Oliveira Penna, Celina M. T. Martelli, Mariane M. A. Stefani, Vanize O. Macedo,
Maria de Fátima Maroja, Aiçar Chaul (2005). «Talidomida no tratamento do eritema nodoso hansênico: revisão sistemática dos ensaios clínicos e perspectivas de novas investigações». Anais Brasileiros da Dermatologia. 80 (5). Consultado em 4 de outubro de 2007 line feed character character in
|author=at position 87 (ajuda) - ↑ a b c Cientista descobre como talidomida provoca má-formação em fetos - O Estado de S.Paulo, 12 de março de 2010 (visitado em 12-3-2010)
- ↑ (em inglês)Takumi Ito, Hideki Ando, Takayuki Suzuki, Toshihiko Ogura, Kentaro Hotta, Yoshimasa Imamura, Yuki Yamaguchi, Hiroshi Handa (12 March 2010). «Identification of a Primary Target of Thalidomide Teratogenicity». Science. 327 (5971). pp. 1345–1350. doi:10.1126/science.1177319. Consultado em 27 de julho de 2010 Verifique data em:
|data=(ajuda) - ↑ «Talidomida aumenta sobrevida de idosos com câncer de medula». 5 de Outubro de 2007. Consultado em 5 de outubro de 2007
- ↑ «Defeitos em bebês elevam temor por uso de talidomida no Brasil, diz 'FT'». 2 de outubro de 2007. Consultado em 2 de outubro de 2007
- ↑ «Fabricante da talidomida pede desculpa 50 anos depois»
- ↑ Ministério da Saúde, Brasil (15 de agosto de 1997). «Portaria SVS/MS Nº 354, de 15 de agosto de 1997». 15/08/1997. Consultado em 31 de agosto de 2013
- ↑ «Resolução SES nº 1504, de 15 de junho de 2000». 2000 Parâmetro desconhecido
|accessdade=ignorado (ajuda) - ↑ «Como Nascemos». Associação Brasileira dos Portadores de Talidomida Parâmetro desconhecido
|accessdade=ignorado (ajuda) - ↑ Revista Juridica - LEI Nº 12.190, DE 13 DE JANEIRO DE 2010 - DOU 14.01.2010
- ↑ Jornal Diário do Nordeste - União vai indenizar deficientes físicos
