Tetrafluoreto de xenônio
| Tetrafluoreto de xenônio Alerta sobre risco à saúde | |
|---|---|

| |
|
|
| Nome IUPAC | Tetrafluoreto de xenônio |
| Outros nomes | Fluoreto de xenônio IV |
| Identificadores | |
| Número CAS | |
| PubChem | |
| ChemSpider | |
| SMILES |
|
| InChI | 1/F4Xe/c1-5(2,3)4
|
| Propriedades | |
| Fórmula molecular | XeF4 |
| Massa molar | 207.2836 g mol−1 |
| Aparência | Sólido branco, cristalino. |
| Densidade | 4.040 g cm−3, solid |
| Ponto de fusão |
117 °C, 390 K, 243 °F |
| Solubilidade em água | Reage violentamente formando gás Xe, O2, XeO3 e HF |
| Estrutura | |
| Geometria de coordenação |
D4h |
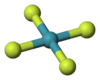
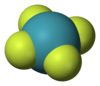
| Forma molecular | Quadrado planar |
| Momento dipolar | 0 D |
| Termoquímica | |
| Entalpia padrão de formação ΔfH |
−251 kJ·mol−1[1] |
| Entropia molar padrão S |
146 J·mol−1·K−1[1] |
| Riscos associados | |
| Principais riscos associados |
Oxidante, Corrosivo (devido ao HF formado nas reações). Perigo de explosão ao reagir com compostos orgânicos e metais. |
| Compostos relacionados | |
| Outros catiões/cátions | Difluoreto de xenônio |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
Tetrafluoreto de xenônio é um composto de fórmula química XeF4.[2]
Características principais
[editar | editar código-fonte]
O tetrafluoreto de xenônio é um composto sólido cristalino e incolor de fórmula química XeF4, formada como um dos subprodutos da reação direta entre os gases flúor e xenônio a cerca de 400°C. Essa reação também produz os compostos XeF2 e XeF6. Tetrafluoreto de xenônio é um composto muito reativo, sendo um poderoso agente oxidante e de fluoração. Assim como o XeF2, ele reage violentamente com a água, com metais e com compostos orgânicos, liberando compostos de flúor e xenônio gasoso:
XeF4 + 2H2O --> Xe + O2 + 4HF
Essa substância é um dos primeiros compostos de gases nobres produzido; sua molécula é um exemplo clássico de molécula hipervalente, ou seja, com mais de 8 elétrons na camada de valência, portanto não segue a regra do octeto. Sendo assim, é uma exceção à regra do octeto.
Precauções de uso
[editar | editar código-fonte]O Tetrafluoreto de xenônio é considerado um composto perigoso, devido à sua alta reatividade química, entre outros fatores. Ele reage violentamente com várias substâncias, podendo provocar explosões e incêndios, além de ser corrosivo (XeF4, ao reagir, pode liberar fluoreto de hidrogênio (HF) como subproduto, que é extremamente corrosivo e pode causar sérias queimaduras que cicatrizam com muita dificuldade). Felizmente, o contato com o XeF4 é muito raro , pois o composto não está disponível comercialmente e é produzido apenas em alguns laboratórios.
Referências
- ↑ a b Zumdahl, Steven S. (2009). Chemical Principles 6th ed. [S.l.]: Houghton Mifflin Company. p. A23. ISBN 0-618-94690-X
- ↑ XeF4: Xenon Tetrafluoride
