Camada de valência

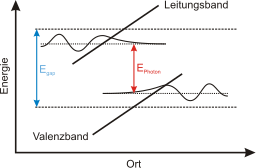
Camada de valência é a última camada a receber elétron no átomo ou o nível de maior número quântico principal e secundário na distribuição eletrônica. Normalmente os elétrons pertencentes à camada de valência são os que participam de alguma ligação química, pois são os mais externos. A contagem e distribuição dos elétrons é feita sempre de dentro (perto do núcleo) para fora.[1][2]
Por Exemplo : - têm 8 elétrons na camada de valência (). A camada de valência é a última camada de distribuição eletrônica, contendo o subnível mais energético. O Diagrama de Pauling estabelece que os átomos podem possuir sete camadas de distribuição atômica. Estas camadas são denominadas .

Cada uma destas camadas possuem um número máximo de elétrons. Assim, as camadas acima possuem, respectivamente elétrons. A camada de valência necessita, na maior parte dos átomos, de elétrons para que seja estável. Essa é a teoria do octeto.
Quando não há estabilidade, os átomos tendem a fazer ligações químicas com elementos que possam proporcionar os elétrons faltantes.
Os gases nobres possuem elétrons em sua camada de valência, a única exceção é Hélio, que possui elétrons. Todos são estáveis, não necessitando realizar ligações químicas para adquirir estabilidade.
Como exemplo das ligações ocorridas em razão dos elétrons presentes na camada de valência, estão o Oxigênio, que possui elétrons na última camada e o Hidrogênio, que possui elétron na ultima camada. O Oxigênio necessita de dois elétrons para ficar estável e o Hidrogênio, de um elétron. Desta forma, ocorre uma ligação em que dois átomos de Hidrogênio compartilham cada um, 1 elétron com o Oxigênio. Assim, o Oxigênio adquire a estabilidade através dos dois elétrons compartilhados, assim como o Hidrogênio, que adquire mais um elétrons na camada de valência. Essa é a ligação que ocorre formando moléculas de água.[3]
Outro exemplo conhecido é o cloreto de sódio ou sal de cozinha. O Cloro possui elétrons na camada de valência. O Sódio, por sua vez, possui um elétron na camada de valência. Assim, o Sódio se torna um cátion, pois perde um elétron, e o Cloro se torna um ânion, pois ganha um elétron.
A representação da tabela periódica permite que, através de uma breve análise, se conclua a respeito da quantidade de elétrons da última camada. Assim, os grupos possuem, respectivamente, elétrons na última camada. Além disso, para o restante dos elementos presentes na tabela periódica, é possível identificar o número de elétrons da camada de valência através da representação da distribuição eletrônica. Assim, tem-se a respeito do elemento Ferro:
Exemplos[editar | editar código-fonte]
- Ferro tem número atômico igual a [1]
- Distribuição eletrônica:
- Camada de valência: no último nível que é com elétrons
- Assim, o elemento Ferro possui elétrons em sua camada de valência.
Assim como o elemento:
- Prata : número atômico igual a
- Distribuição eletrônica:
- Camada de valência: no último nível que é com elétrons
- Assim, o elemento Prata possui elétron em sua camada de valência.
Desta forma, é possível ligações iônicas ou covalentes, em diversos elementos e sua provável transformação em cátions e ânions.
Em resumo, a camada de valência sempre será a última camada da distribuição eletrônica.
Ver também[editar | editar código-fonte]
Referências
- ↑ a b Camada de Valência
- ↑ Peter W. Atkins, Loretta Jones, Principios de Química : Questionando a Vida Moderna e o Meio Ambiente , Bookman ISBN 8-540-70054-9
- ↑ Raymond Chang, Química Geral, McGraw Hill Brasil, 1975 ISBN 8-563-30817-3
Bibliografia[editar | editar código-fonte]
- C.G. Van de Walle, Wide-band-gap Semiconductors, Elsevier, 1993 ISBN 0-444-59917-7 (em inglês)
- Hadis Morkoç, Handbook of Nitride Semiconductors and Devices, GaN-based Optical and Electronic Devices , John Wiley & Sons, 2009 ISBN 3-527-62845-2 (em inglês)
- E. Kasper, D.J. Paul, Silicon Quantum Integrated Circuits: Silicon-Germanium Heterostructure Devices: Basics and Realisations , Springer Science & Business Media, 2006 ISBN 3-540-26382-9 (em inglês)
- S. Kar, Electrochemical Society. Electronics Division , Physics and Technology of High-k Gate Dielectrics II: Proceedings of the Second International Symposium on High Dielectric Constant Materials: Materials Science, Processing, Reliability, and Manufacturing Issues : Held in Orlando, Florida, October 12-16, 2003, Volume 2003, The Electrochemical Society, 2004 ISBN 1-566-77405-5 (em inglês)
- Klaus Ellmer, Andreas Klein, Bernd Rech, Transparent Conductive Zinc Oxide: Basics and Applications in Thin Film Solar Cells , Springer Science & Business Media, 2007 ISBN 3-540-73612-3 (em inglês)
- Joshi, Engineering Physics , Tata McGraw-Hill Education, 2010 ISBN 0-070-70477-5 (em inglês)
- Larry Brown, Tom Holme, Chemistry for Engineering Students , Cengage Learning, 2014 ISBN 1-285-96557-4 (em inglês)
- H.H. Kung, Transition Metal Oxides: Surface Chemistry and Catalysis , Elsevier, 1989 ISBN 0-080-88742-2 (em inglês)
- Peter W. Milonni, Joseph H. Eberly, Laser Physics , John Wiley & Sons, 2010 ISBN 0-470-40970-3 (em inglês)
- Jerrold T. Bushberg, John M. Boone, The Essential Physics of Medical Imaging , Lippincott Williams & Wilkins, 2011 ISBN 0-781-78057-8 (em inglês)






















