Hexafluoroetano
| Hexafluoroetano Alerta sobre risco à saúde | |
|---|---|
|
|
| Outros nomes | Carbon hexafluoride, 1,1,1,2,2,2-Hexafluoroethane, Perfluoroethane, Ethforane, Halocarbon 116, PFC-116, CFC-116, R-116, Arcton 116, Halon 2600, UN 2193 |
| Identificadores | |
| Número CAS | |
| PubChem | |
| Número EINECS | |
| ChemSpider | |
| ChEBI | |
| Número RTECS | KI4110000 |
| SMILES |
|
| InChI | 1/C2F6/c3-1(4,5)2(6,7)8
|
| Propriedades | |
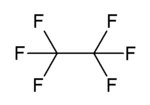
| Fórmula molecular | C2F6 |
| Massa molar | 138.01 g.mol−1 |
| Aparência | Colorless odorless gas |
| Densidade | 5.734 kg.m−3 at 24 °C |
| Ponto de fusão |
−100.6 °C, 173 K, -149 °F |
| Ponto de ebulição |
−78.2 °C, 195 K, -109 °F |
| Solubilidade em água | 0.0015% |
| log P | 2 |
| kH | 0.000058 mol.kg−1.bar−1 |
| Riscos associados | |
| NFPA 704 | |
| Ponto de fulgor | Non-flammable |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
O hexafluoroetano é a o perfluorocarbono equivalente ao hidrocarboneto etano. É um gás não inflamável pouco solúvel em água e pouco solúvel em álcool. É um gás de efeito estufa extremamente potente e de longa duração.
Propriedades físicas[editar | editar código-fonte]
A fase sólida do hexafluoroetano tem dois polimorfos. Na literatura científica, têm sido indicadas diferentes temperaturas de transição de fase. Os trabalhos mais recentes a transição a 103 Kelvin (−170°C). Abaixo de 103 K tem uma estrutura levemente desordenada, e acima do ponto de transição tem uma estrutura cúbica de corpo centrado. [1] O ponto crítico está em 19,89 °C (293,04 K) e 30,39 bar. [2]
| Estado, temperatura | Densidade (kg.m −3 ) |
|---|---|
| líquido, -78,2 °C | 16.08 |
| gás, -78,2 °C | 8,86 |
| gás, 15 °C | 5,84 |
| gás, 20,1 °C | 5.716 |
| gás, 24 °C | 5.734 |
A densidade de vapor é 4,823 (ar = 1), gravidade específica a 21 °C é 4,773 (ar = 1) e volume específico a 21 °C é 0,1748 m3 /kg.
Usos[editar | editar código-fonte]
O hexafluoroetano é usado como um decapante versátil na fabricação de semicondutores.[3] Ele pode ser usado para gravação seletiva de óxidos e silícios metálicos versus seus substratos metálicos e também para gravação de dióxido de silício sobre silício. As indústrias de fabricação de alumínio primário e semicondutores são os principais emissores de hexafluoretano usando o processo Hall-Héroult .[4]
Efeitos ambientais[editar | editar código-fonte]

Devido à alta energia das ligações CF, o hexafluoretano é quase inerte e, portanto, atua como um gás de efeito estufa extremamente estável, com uma meia vida atmosférica de 10.000 anos (outras fontes apontando 500 anos). [5] Tem um potencial de aquecimento global (GWP) de 9200 e um potencial de destruição do ozônio (ODP) de 0. O hexafluoretano está incluído na lista de gases de efeito estufa do IPCC.
O hexafluoretano não existia em quantidades significativas no meio ambiente antes da fabricação em escala industrial. A concentração atmosférica de hexafluoroetano atingiu 3 pptv no início do século XXI. [6] Suas bandas de absorção na parte infravermelha do espectro causam um forçamento radiativo de cerca de 0,001 W/m2. .
Veja também[editar | editar código-fonte]
Referências[editar | editar código-fonte]
- ↑ Zeng, S.X.; Simmons, R.O.; Timms, D.N.; Evans, A.C. (1999). «Dynamics and structure of solid hexafluoroethane». Journal of Chemical Physics. 110 (3): 1650–61. Bibcode:1999JChPh.110.1650Z. doi:10.1063/1.477806
- ↑ Helmut Schan: Handbuch der reinsten Gase. Springer, 2005, ISBN 978-3-540-23215-5, S. 307.
- ↑ PubChem. «Hexafluoroethane». pubchem.ncbi.nlm.nih.gov (em inglês). Consultado em 10 de novembro de 2022
- ↑ Marks, Jerry; Kantamaneni, Ravi; Pape, Diana; Rand, Sally (8 de abril de 2013). «Protocol for Measurement of Tetrafluoromethane and Hexafluoroethane from Primary Aluminum Production». Hoboken, NJ, USA: John Wiley & Sons, Inc.: 1032–1036. Consultado em 10 de novembro de 2022
- ↑ «Perfluoroethane CASRN: 76-16-4». TOXNET Toxicology Data Network. National Library of Medicine. 25 de outubro de 2016
- ↑ «Climate Change 2001: The Scientific Basis». Consultado em 2 de junho de 2007. Arquivado do original em 15 de junho de 2007

