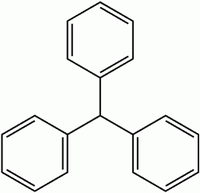
Trifenilmetano
| Trifenilmetano Alerta sobre risco à saúde | |
|---|---|
| |

| |
| Nome IUPAC | Triphenylmethane |
| Outros nomes | 1,1',1"-Methylidynetrisbenzene |
| Identificadores | |
| Número CAS | |
| Número EINECS | |
| SMILES |
|
| Propriedades | |
| Fórmula molecular | C19H16 |
| Massa molar | 244.33 g/mol |
| Densidade | 1.014 g/cm3 |
| Ponto de fusão |
92-94 °C |
| Ponto de ebulição |
359 °C |
| Solubilidade em água | insolúvel |
| Riscos associados | |
| MSDS | External MSDS |
| Frases R | R36 R37 R38 |
| Compostos relacionados | |
| Hidrocarbonetos aromáticos relacionados | Difenilmetano Tetrafenilmetano |
| Compostos relacionados | Trifenilmetanol Trifenilamina Trifenilborano Pararosanilina (um corante triarilmetano) Ácido rosólico |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
O trifenilmetano (ou tritano) é um sólido incolor que apresenta três grupos fenilo e um átomo de hidrogênio unidos a um átomo de carbono. Derivados desta estrutura se encontram no centro de numerosos corantes (que são chamados, também, de derivados e corantes de triarilmetano).
Dados físico-químicos[editar | editar código-fonte]
- Fórmula: H-C(C6H5)3 = C19H16
- Massa molecular: 244,33 g/mol
- Ponto de fusão: 92 - 94 ºC
- Ponto de ebulição: 358 - 359 ºC
- Densidade: 1,014 g/ml (25 ºC)
- Número CAS: 519-73-3
Síntese[editar | editar código-fonte]
A síntese do trifenilmetano pode realizar-se mediante alquilação de Friedel-Crafts a partir de benzeno e clorofórmio em presença de tricloreto de alumínio como catalisador.
Normalmente o rendimento é maior se em vez de clorofórmio se utiliza dicloreto de benzilideno (C6H5CHCl2; disponível a partir de benzaldeído e pentacloreto de fósforo).
Reatividade[editar | editar código-fonte]
O hidrogênio sobre o carbono central do trifenilmetano pode-se remover facilmente tanto na forma de hidreto como na forma de próton já que o íon correspondente é estabilizado por mesomeria com possibilidade de passar a carga aos anéis fenílicos. Este efeito é ainda mais forte nos sistemas que levam substituintes +M ou -M (que têm efeito eletron-doador ou elétron-atrator por mesomeria) em posição orto ou para.
Também o radical de trifenilmetil é estabilizado pelo mesmo efeito e se trata do primeiro radical orgânico estável descrito. Usualmente não é obtido a partir do mesmo trifenilmetano senão por redução do cloreto correspondente com sódio metálico.
- (C6H5)3CCl + 2 Na → (C6H5)3CNa + NaCl
A dimerização é impedida além disso por efeitos estéricos de repulsão entre os grupos fenilo. No dímero formado ao guiardar o radical em dissolução uma unidade se une através do carbono central a um anél fenílico da outra molécula com perda da aromaticidade do anel afetado.
Aplicações[editar | editar código-fonte]
O próprio trifenilmetano não tem aplicações destacadas porém a estrutura se encontra em muitos corantes como a fenolftaleína (resultante da condensação entre o fenol e o anidrido ftálico), o verde de bromocresol e o verde malaquita, etc.