Fenolftaleína
| Fenolftaleína Alerta sobre risco à saúde | |
|---|---|

| |
| Nome IUPAC | 3,3-Bis(4-hidroxifenil)-1(3H)-isobenzofuranona |
| Outros nomes | ácido 2-(bis-(4-hidroxifenil)metil)benzoico, 3,3-bis(p-hidroxifenil)ftálido, NCI-C55798 |
| Identificadores | |
| Número CAS | |
| SMILES |
|
| Propriedades | |
| Fórmula molecular | C20H14O4 |
| Massa molar | 318,323 g mol−1 |
| Densidade | 1,277 g cm−3, a 32 °C |
| Ponto de fusão |
262,5 °C |
| Ponto de ebulição |
N/A |
| Solubilidade em água | (4g/L) |
| Solubilidade em outros solventes | Insolúvel em benzeno, muito solúvel em etanol e éter, ligeiramente solúvel em DMSO. |
| Riscos associados | |
| Frases R | R36, R37, R38 |
| Frases S | S26 |
| Compostos relacionados | |
| Compostos relacionados | Trifenilmetano Timolftaleína (+2 metil, +2 isopropil) 1-Naftolftaleína (em vez de fenóis, naftóis) Vermelho de fenol (no pentágono, em vez de -C=O-, -SO2-) |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
A fenolftaleína é um indicador de pH com a fórmula C20H14O4. Apresenta-se normalmente como um sólido em pó branco ou em solução alcoólica como um líquido incolor. É pouco solúvel em água, porém solúvel em etanol (álcool etílico). É utilizada para medir o pH (acidez ou alcalinidade) de soluções, e foi usado em "medicações" (hoje proibidas no Brasil, por exemplo), embora muito prejudicial à saúde.
Usos[editar | editar código-fonte]
| Fenolftaleína (indicador de pH) | ||||
| pH abaixo de 8
Ácido |
pH entre 8,0 e 10,0
Neutro |
pH entre 10,0 e 12,0
Base | ||
| incolor | ⇌ | rosa | ⇌ | carmim ou roxo |
Utilizada frequentemente em titulações, na forma de suas soluções alcalinas, mantém-se incolor em soluções ácidas e torna-se cor-de-rosa em soluções básicas.[1] A sua cor muda a valores de pH entre pH 8,2 e pH 9,8. Se a concentração do indicador for particularmente forte, pode tomar uma cor carmim ou fúcsia.
Por esta propriedade e sua destacada e intensa cor é também um componente em indicador universal, uma solução consistindo de uma mistura de indicadores de pH (normalmente fenolftaleína, vermelho de metila, azul de bromotimol e azul de timol, entre outros em variações.[2]
Perícia criminal: detecção de sangue seco pelo Teste de Kastle-Meyer[editar | editar código-fonte]
O Teste de Kastle-Meyer visa à identificação de sangue seco em superfícies. Procede-se com a coleta de amostra do resíduo biológico seco passando um cotonete de algodão na superfície que se deseja testar. Pingam-se algumas gotas de álcool etílico na cabeça de algodão do cotonete que entrou em contato com a superfície, seguidas de gotas de fenolftaleína e, por fim, de peróxido de hidrogênio. A fenolftaleína, como indicador de pH, possui a propriedade de apresentar coloração rosada em meio básico. Como o sangue é uma substância alcalina, se a reação apresentar imediatamente uma coloração rosada, fica comprovado que há sangue seco naquela superfície. Contudo, deve-se ter cuidado: após trinta segundos, o algodão começa lentamente a tornar-se rosado devido à própria oxidação, causada pelo peróxido de hidrogênio. A reação não é destrutiva, ou seja, preserva as moléculas de DNA do sangue para posterior análise em laboratório para fins de identificação. Entretanto, este teste tem a mesma reação com sangue de qualquer animal, consequentemente necessita-se identificar se sua origem é humana ou não.
Fármaco[editar | editar código-fonte]
A fenolftaleína foi também utilizada como laxante que age por irritação do intestino. Era comercializada na forma de pequenas bolinhas brancas ou na forma líquida. No entanto, tem cheiro desagradável e existem medicações adequadas para a prisão de ventre, que não a fenolftaleína.
No Brasil, o uso da fenolftaleína como laxante foi proibido pela ANVISA por suspeita de ser cancerígeno.[3][4] Os medicamentos que a continham como laxante eram o Lacto-Purga e o Almeida Prado nº 46 (este último, a despeito de fazer parte de uma linha de "medicamentos" homeopáticos) que, agora, não mais a contêm.
Produtos com alteração de cor[editar | editar código-fonte]
Fenolftaleína é usada em alguns brinquedos, para desenvolver o cabelo e padrões gráficos "mágicos", a tinta é espargida com uma solução de hidróxido, a qual conduz a aparição de caracteres destacados pelo mesmo mecanismo descrito acima para a mudança de cor em solução alcalina. O padrão irá eventualmente desaparecer pelo mesmo mecanismo de reação com dióxido de carbono detalhado anteriormente. Timolftaleína é usado para o mesmo propósito, quando cor azul é desejada.[1]
Comportamento químico em função do pH[editar | editar código-fonte]
A fenolftaleína é frequentemente utilizada em titulações ácido-base, sendo que sua coloração muda de incolor em meio ácido para rosa em soluções básicas. Se a concentração do indicator é particularmente forte, ela poderá apresentar-se como púrpura. Em soluções fortemente básicas (pH maior que 12), a coloração rosa da fenolftaleína submete-se lentamente a uma reação de descoloração e torna-se incolor novamente. Essa reação mais lenta, que produz o íon InOH3−, é algumas vezes utilizada em aulas de química para o estudo da cinética química.
A molécula tem quatro formas:
| Espécie | H3In+ | H2In | In2− | In(OH)3− |
|---|---|---|---|---|
| Estrutura | 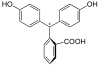 |
 |
 |

|
| Modelo |  |
 |
 |

|
| pH | <0 | 0−8.2 | 8.2−12.0 | >12.0 |
| Condições | fortemente ácida | ácida ou próximo do neutro | básica | fortemente básica |
| Cor | laranja | rosa a magenta | incolor | |
| Imagem |  |
 |

|
| Mecanismo de reacção: H3In+ → H2In → In2− → In(OH)3− |
Obtenção[editar | editar código-fonte]
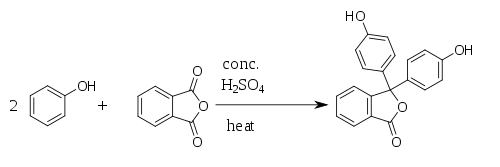
Fenolftaleína é sintetizada pela condensação de anidrido ftálico com dois equivalentes de fenol sob condições ácidas (daí seu nome). Foi descoberta em 1871 por Adolf von Baeyer.[5][6][7]
Ver também[editar | editar código-fonte]
Referências[editar | editar código-fonte]
- ↑ Chang, Raymond (1 de janeiro de 2009). Química Geral. [S.l.]: McGraw Hill Brasil. ISBN 9788563308177
- ↑ Universal Indicator ISCID Encyclopedia of Science and Philosophy - www.iscid.org Arquivado em 25 de setembro de 2006, no Wayback Machine. (em inglês)
- ↑ «Resolução de alerta da Anvisa». Consultado em 19 de setembro de 2007. Arquivado do original em 7 de maio de 2010
- ↑ «RESOLUÇÃO - RE Nº 571, de 5 de Abril de 2002, com a proibição final da Anvisa». Consultado em 19 de setembro de 2007. Arquivado do original em 12 de setembro de 2007
- ↑ Baeyer, A. (1871). «Ueber eine neue Klasse von Farbstoffen». Berichte der Deutschen Chemischen Gesellschaft. 4 (2): 555–558. doi:10.1002/cber.18710040209
- ↑ Baeyer, A. (1871). «Ueber die Phenolfarbstoffe». Berichte der Deutschen Chemischen Gesellschaft. 4 (2): 658–665. doi:10.1002/cber.18710040247
- ↑ Baeyer, A. (1871). «Ueber die Phenolfarbstoffe». Polytechnisches Journal. 201 (89): 358–362
Ligações externas[editar | editar código-fonte]
- «MSDS da fenolftaleína» (em inglês)
- ACID-BASE INDICATORS - www.chemguide.co.uk (em inglês)
