Ácido nitroso
| Ácido Nitroso Alerta sobre risco à saúde | |
|---|---|
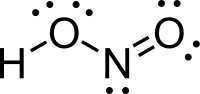
| |
| Identificadores | |
| Número CAS | |
| Propriedades | |
| Fórmula química | HNO2 |
| Massa molar | 47 g mol-1 |
| Aparência | Solução pálida azul |
| Densidade | Aprox. 1 g/ml |
| Acidez (pKa) | 3.398 |
| Riscos associados | |
| Ponto de fulgor | Non-flammable |
| Compostos relacionados | |
| Outros aniões/ânions | Ácido nítrico |
| Outros catiões/cátions | Nitrito de sódio Nitrito de potássio Nitrito de amônia |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
Ácido Nitroso é um ácido do nitrogênio cujo estado de oxidação é +3. Tem fórmula química HNO2. É formado por um átomo de Hidrogênio, um de Nitrogênio e dois de Oxigênio. Sua massa molecular pode ser calculada pela soma das massas atômicas de seus elementos 1+14+(16x2)=47.(Dioxonítrico)[1]
Estrutura
[editar | editar código-fonte]Na fase gasosa, a molécula de ácido nitroso planar pode adoptar um tanto na forma cis e trans. A forma trans predomina em temperatura ambiente, e indicadores medições em Infravermenho de estabilidade por volta de .[2]
-
dimensões da forma trans (a partir do espectro de microondas).
-
modelo da 'forma' 'trans'.
-
Forma cis.
Classificação
[editar | editar código-fonte]É oxiácido, é considerado médio, seu grau de ionização é igual 0,08. Este monoácido ou monoprotônico possui um alto grau de reversibilidade, pois de cada 100 moléculas dissolvidas, 92 se regeneram e apenas 8 se ionizam. É um ácido ternário, inorgânico e instável.
Reação de dissociação eletrolítica do ácido nitroso
[editar | editar código-fonte]Este ácido se dissolve facilmente em água, conforme a propriedade, produzindo o cátion Hidrônio ou Hidroxônio . O desenho mostra o hidrogênio do ácido ao lado de um dos pares eletrônicos do oxigênio da água. Observe que é o próton do hidrogênio que se desloca emprestando assim sua carga positiva, e seu elétron foi deixado no ânion de onde advém a sua carga negativa: pode-se dizer que o núcleo do átomo de hidrogênio foi separado de seu elétron. Esta reação é comum a todos os ácidos e o ânion nitrito pode ser representado assim.
O desenho ao lado é um demonstrativo do que foi explicado, a migração do hidrogênio até o par eletrônico da água. A água tem uma natureza polar por isso facilmente atrai o próton do hidrogêno.
Processos de obtenção do ácido nitroso
[editar | editar código-fonte]Conforme diversos autores de livros de química, dentre eles destacam-se Química Geral de Linus Pauling, destacam-se três processos comuns de laboratório para obtenção do ácido nitroso.
Primeiro processo
[editar | editar código-fonte]Dissolvendo-se Dióxido de Nitrogênio em água, formam-se dois ácidos simultaneamente, ácido nítrico e ácido nitroso que podem ser separados facilmente pela adição de um álcalino, conforme a reação abaixo
Segundo processo
[editar | editar código-fonte]Decomposição térmica dos nitratos em nitritos. Podem-se usar mais facilmente os nitratos de sódio ou potássio, obtendo-se nitritos correspondentes.
Terceiro processo
[editar | editar código-fonte]Redução de nitratos pelo chumbo. Os sais produzidos têm uma coloração amarelo-pálida, embora suas soluções sejam amarelo mais intenso.
Propriedades do ácido nitroso
[editar | editar código-fonte]Entre as propriedades mais comuns podemos citar
Reação de salificação do ácido nitroso
[editar | editar código-fonte]Todo ácido, quando em presença de uma base, produz sal e água. Esta propriedade é comum a todos os ácidos. A reação pode ser representada assim
Reação com as aminas
[editar | editar código-fonte]Estas reações servem como método de identificação das aminas.[1]
- Aminas não aromáticas
- Estas aminas reagem com o ácido nitroso formando um álcool, água e gás nitrogênio, que se desprende em forma de bolhas.
- Aminas aromáticas
- As aminas aromáticas em presença do ácido nitroso produzem nitroso-aminas e água. É seguro dizer que as aminas secundárias não aromáticas têm um comportamento idêntico.

Ver também
[editar | editar código-fonte]Referências
- ↑ a b «Ácido nitroso». Consultado em 27 de outubro de 2014. Arquivado do original em 24 de setembro de 2015
- ↑ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 0-080-37941-9. (em inglês) p. 462
Bibliografia
[editar | editar código-fonte]- Michael M. Cox | Jennifer A. Doudna | Michael O’Donnell, Biologia Molecular: Princípios e Técnicas; Artmed, 2012, ISBN 8-536-32741-3
- Academia das Ciências de Lisboa, Jornal de sciencias mathematicas, physicas e naturaes, Oxford University , ISBN 1-113-43598-4 ISBN 1-140-43346-6 (em inglês)
- Gerard J. Tortora | Berdell R. Funke | Christine L. Case , Microbiologia , Artmed, 2012 ISBN 8-536-32698-0
- United States Coast Guard, Regia Officina Typografica , Pharmacopeia Geral Para O Reino O Dominios de Portugal; Tomo II, Medicamentos Simplices, Preparados E Compostos Paperback, ISBN 1-155-07214-6 (em inglês)
- Peter Vollhardt, Neil E. Schore, Química Orgânica - 6.ed.: Estrutura e Função , Bookman Editora, 2013 ISBN 8-565-83732-7
- Arnaldo Zaha, Henrique Bunselmeyer Ferreira, Luciane M. P. Passaglia, Biologia Molecular Básica - 5.ed. , Artmed Editora, 2014 ISBN 8-582-71058-5
- Grupo de Pesquisa em Educacao Quimica , Interações e Transformações: Professor - A Química e a Sobrevivência - Atmosfera/Fonte de Materiais Vol. 3, EdUSP ISBN 8-531-40718-4
- Catherine E. Housecroft; Alan G. Sharpe (2008). "Chapter 15: The group 15 elements". Inorganic Chemistry, 3rd Edition. Pearson. ISBN 978-0-13-175553-6. (em inglês)
- Prudent practices in the laboratory: handling and disposal of chemicals. Washington, D.C.: National Academy Press. 1995. ISBN 0-309-05229-7. (em inglês)












