Conformação do cicloexano

A conformação do cicloexano é um tópico muito estudado em química orgânica devido às complexas inter-relações entre os diferentes confórmeros do cicloexano e seus derivados. Quando os confórmeros são diferentes podem variar suas propriedades, incluindo sua estabilidade e reatividade química.[1][2][3][4][5][6][7]
História
[editar | editar código-fonte]A primeira sugestão de que o cicloexano podia não ser uma molécula plana existia na história da química desde o século XIX. Em 1890, Hermann Sachse, um assistente de 28 anos em Berlím, publicou instruções para dobrar uma folha de papel para representar duas formas de cicloexano que ele chamou simétrica e não simétrica (o que agora chamaríamos cadeira e bote). Claramente entendeu que essas formas tem duas posições para hidrogênios (novamente, para usar a terminologia moderna, axial e equatorial), que duas formas “cadeiras” provavelmente se interconvertiam entre si, e até mesmo como certos substituintes favoreciam formas “cadeira”. Como ele expressou tudo em linguagem matemática, poucos químicos da época entenderam seus argumentos. Ele fez algumas tentativas de publicar suas idéias, mas nenhuma conseguiu capturar a imaginação dos químicos. Sua morte, em 1893, aos 31 anos, significou que suas idéias mergulharam na obscuridade. Foi apenas em 1918 quando Ernst Mohr, usando a nova técnica da cristalografia de raios X, foi capaz de determinar a estrutura do diamante, reconhecendo o modelo de cadeira de Sachse.[8][9][nota 1]
Conformação de cadeira
[editar | editar código-fonte]Devido à tendência inerente de orbitais híbridos sp3 dos átomos de carbono tetravalentes de formar ângulos de ligação de 109.5 °, o cicloexano não forma um arranjo hexagonal plano com ângulos internos de 120 °. A conformação de cadeira é um termo usado para a conformação química mais estável de um anel de seis átomos de carbono unidos por ligação simples, como o cicloexano. Derek Barton e Odd Hassel compartilharam o Prêmio Nobel por seu trabalho nas conformações do cicloexano e outras moléculas.
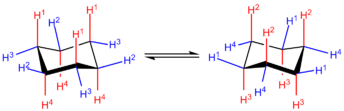
Na conformação de cadeira de mínima energia, 6 dos 12 hidrogênios estão em posições axiais (coloridas de vermelho)—suas ligações C-H são paralelas umas com as outras e parecem dispor-se acima e abaixo da estrutura do anel, os outros 6 estão em posições equatoriais (coloridas de azul)-estão dispostos ao redor do perímetro do anel. Note-se que, além disso, um hidrogênio em cada posição está "acima" em relação ao outro que está "abaixo" nessa posição.
Ao percorrer o anel, pode-se ver que as posições axiais para cima (H1 na estrutura à esquerda) alternam-se com posições equatoriais para cima (H2). Além disso, as posições axiais alternam os lados ao redor do anel (H1 axial-acima vs H4 axial-abaixo) e do mesmo modo as posições equatoriais (H2 equatorial-acima vs H3 equatorial-abaixo). Para dois substituintes ligados a carbonos adjacentes no anel como no trans-1,2-cicloexano, os substituintes devem ser axiais ou equatoriais, para permanecerem em lados opostos do anel. De modo similar, para o cis-1,2-cicloexano, uma substituição deve ser axial e a outra equatorial, ou vice-versa. São possíveis outros vários esquemas de substituição, cada um seguindo os mesmos esquemas relativos de posicionamento geométrico.
Em um processo conhecido como inversão do anel ou inversão da cadeira, a conformação do anel muda, conduzindo aos hidrogênios axiais a serem equatoriais, e os hidrogênios equatoriais a serem axiais. Porém, a direção relativa dos hidrogênios ao anel segue sendo a mesma: um hidrogênio axial "acima", quando se inverte, permanece como um hidrogênio equatorial "acima". As duas conformações de cadeira podem diferir em estabilidade, dependendo da identidade dos grupos funcionais. Geralmente, os substituintes são mais estáveis quando estão em posições equatoriais, pois neste caso não há interação diaxial 1,3 entre o grupo substituinte axial e qualquer outro grupo axial no anel. Por exemplo, se há um grupo metilo no carbono 1 em uma posição axial, irá interagir com os hidrogênios axiais no carbono 3 e carbono 5. Entretanto, quando há heteroátomos eletronegativos envolvidos, pode observar-se o contrário; isto é denominado o efeito anomérico. O cicloexano se encontrará na conformação de cadeira em 99,99% a 25 °C (isto é, 99,99% de todas as moléculas em uma amostra de solução estarão na conformação de cadeira).
A preferência de um substituinte para a conformação equatorial é medida em termos de seu valor A, que é a diferença na energia livre de Gibbs entre os confórmeros equatorial e axial. Um valor positivo de A indica preferência em direção a posição equatorial. A magnitude dos valores de A variam de quase zero a substituintes muito pequenos, como deutério, até aproximadamente 5 kcal/mol para substituintes muito volumosos como o grupo tert-butilo.
Conformação de bote
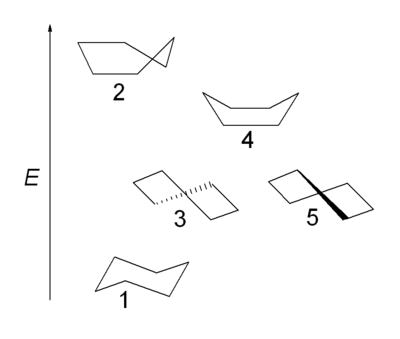
[editar | editar código-fonte]Além da conformação de cadeira (1) com simetria D3d, o cicloexano pode existir nos confórmeros de média cadeira ou envelope (2), torcida ou bote torcido (3,5) com simetria D2 e bote (4). A forma de cadeira apresenta um mínimo de energia potencial. A conformação de bote não sofre de tensão angular, mas tem uma energia mais alta que a forma de cadeira devido à tensão estérica resultante dos dois átomos de hidrogênio 1,4 na que é chamada interação de mastro de bandeira. A tensão torsional na conformação de bote tem um valor máximo porque duas das ligações de carbono estão eclipsadas. Comparado com a conformação alternada das ligações na forma cadeira, e a ausência completa de tensão torsional, ou a conformação de bote torcido com 4 de 6 ligações parcialmente alternadas. Na conformação de média cadeira, 4 átomos de carbono estão localizado em um plano, no qual duas ligações estão completamente eclipsados.
As formas de barco e envoltório são estados de transição entre as formas torcida e cadeira, e são impossíveis de ser isolada. A conformação de bote torcido é 5,5 kcal/mol (23 kJ/mol) menos estável que a conformação de cadeira. As energias dos dois estados de transição são 6,6 kcal/mol (28 kJ/mol) (bote) e 10,8 kcal/mol (45 kJ/mol) (média cadeira) maiores que a de cadeira.[10] O processo de inversão do anel pode ser descrito com mais precisão como ocorrendo através de uma conformação de bote torcido, e dois estados de transição de média cadeira.
A diferença de energia entre a conformação de cadeira e a de barco torcido pode ser medida indiretamente tomando a diferença em energia de ativação para a conversão da conformação de cadeira à de bote torcido, e da isomerização reversa. A concentração de conformação de bote torcido à temperatura ambiente é muito baixa (menor que 0,1%) mas a 1073 K, esta concentração pode alcançar os 30%. A reação inversa é medida por espectroscopia infravermelho depois de introduzir-se rapidamente o cicloexano desde 1073 K a 40 K, congelando na grande concentração de conformação bote torcido.
O [6.6]quiralano[11][12] é uma molécula com grupo de pontos T, composta completamente de cicloexanos idênticos em bote fundidos. O twistano é outro composto com uma conformação forçada de bote torcido.
Equilíbrio conformacional
[editar | editar código-fonte]Como vimos antes, Baeyer considera o ciclo-hexano como uma molécula planar, mas um anel planar de seis membros tem ângulos de ligação de 120o e assim, o composto tem átomos de carbono com hibridação sp3, teria tensão angular apreciável. Além disso, todos os grupos CH2 adjacentes eclipsariam o que gera uma tensão conformacional. Para evitar estas interações desfavoráveis, a estrutura adota conformações não-planares9[13]. Sachse, 100 anos mais tarde, reconheceu que pode haver uma conformação de “cadeira”, “barco” ou “barco torcido”.[14]

Estas três conformações estão libres de tensão angular, já que conservam ângulos de ligação de aproximadamente 109o; sendo a conformação cadeira a de mais baixa energia. Por tanto, pode-se esperar que o ciclo-hexano e a maioria de seus derivados existam na forma de cadeira[15]. Sashi também reconheceu que o ciclo-hexano pode inverter a conformação cadeira. Neste processo os átomos em posição axial passam a posição equatorial e vice-versa.[14]

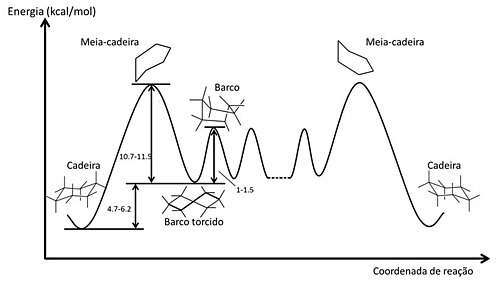
Como mostrado na figura, a inversão da conformação cadeira, não é um processo de um só passo[16]. O primeiro passo produz um intermediário que depois numa etapa de igual energia produz a cadeira invertida. A energia de ativação para o processo de interconversão de cadeira - barco é 10,7-11,5 kcal/mol, o equivalente a 100.000 inversões por segundo à temperatura ambiente[15]. Vários estudos estabelecem que a conformação de barco torcido é 1-1,5 kcal/mol mais estável do que o barco. Em 1975, Squillacote, Chapman e Anet conseguiram capturar a conformação de barco torcido por uma técnica de isolamento em que fez-se um resfriamento rápido até -253oC de uma mistura de vapor de ciclo-hexano e argônio previamente aquecido a cerca de 800oC.[14]
Derivados de cicloexano
[editar | editar código-fonte]Os substituintes encontrados no cicloexano adotam formações cis e trans e não podem intercambiar-se facilmente por uma rotação simples de ligação sigma como ocorre com as moléculas lineares. A formação cis significa que ambos substituintes estão no lado superior dos dois sítios substituintes em cada carbono, enquanto que trans significaria que estão em lados opostos. Apesar do hecho de que os átomos de carbono no cicloexano estão unidos por uma ligação simples, o anel permanece rígido, devido a que o intercâmbio de cis a trans requeriria a ruptura do anel. A nomenclatura para cis é indicada por (Z), enquanto que o nome para trans é (E) à frente do nome IUPAC.
Ciclo-hexanos dissubstituídos
[editar | editar código-fonte]Os ciclo-hexanos dissubstituídos 1,2-, 1,3-, 1,4- podem existir como isômeros cis e trans. Quando os dois substituintes são idênticos, os isômeros cis-1,2 e cis-1,3 são formas meso, enquanto os isômeros trans correspondentes são quirais. Nas series dissubstituídas 1,4-, ambas as formas cis e trans são aquirais independentemente dos substituintes.[17] Para o cicloexano com substituições 1,2 e 1,4, uma configuração trans conduz, bem a ambos os grupos axiais, ou ambos equatoriais. Neste caso, a conformação diaxial é evitada efetivamente por seu alto impedimento estérico (quatro interações gauche mais que a diequatorial). Para os cicloexanos 1,3-dissubstituídos, a forma cis é diequatorial e a conformação invertida sofre interações estéricas adicionais entre os dois grupos axiais. Os cicloexanos 1,3-dissubstituídos em trans são como o cis-1,2- e cis-1,4- e pode inverter-se entre as duas formas equivalentes axial/equatorial.
Existem derivados de cicloexano que tem uma conformação de bote torcido mais estável. Um exemplo é o 1,2,4,5-tetratiano, um composto organosulfurado em que a troca de 4 grupos metileno por enxofre elimina as interações desfavoráveis di-axiais 1,3. No análogo tetrametil 3,3,6,6-tetrametil-1,2,4-5-tetratiano, a conformação de bote torcido é a que domina realmente. Também na cicloexano-1,4-diona com a interação estérica de hidrogênio 1,4 eliminada, a conformação mais estável é realmente a de bote torcido.
O cis-1,4-di-tert-butilcicloexano tem um grupo axial terc-butil na conformação de cadeira, e a conversão à conformação de bote torcido ubica a ambos grupos nas posições equatoriais que são mais favoráveis. Como resultado, a conformação de bote torcido é mais estável por 0,47 kcal/mol (1,96 kJ/mol) a 125K, de acordo com medições por espectroscopia RMN.
Quando dois ou mais substituintes estão presentes num anel de ciclo-hexano, as interações entre os substituintes devem ser incluídas na análise. Os dimetilciclohexanos proporcionam uma análise conformacional de fácil interpretação e com boa concordância com os dados experimentais.
O diastereômero mais estável em cada caso é aquele em que ambas os grupos metílas são equatoriais. O ΔG é semelhante para cada um dos isómeros diequatorial (1,9 kcal/mol) e é muito perto do valor de ΔG conformacional do metilciclohexano (1,8 kcal/mol). Isto implica que não há interações importantes adicionais no dimetilciclohexano em comparação com o metilciclohexano. Isto é razoável, porque em cada caso, o grupo metil axial interage apenas com os hidrogênios 3,5-diaxal6.

Conformação do cicloexeno
[editar | editar código-fonte]A presença de ligações duplas gera mudanças do nas propriedades dos ciclos. Quando centros sp2 são incorporados em anéis de seis membros a barreira de energia para a inversão no anel, é reduzida para 7,7 kcal / mol no ciclo-hexeno (considerando que para o cicloexano é 10,3 kcal/mol) e 4,9 kcal/mol em cicloexanona. A conformação de cicloexeno é descrito como meia-cadeira. Parâmetros estruturais determinados por difração de elétrons e espectroscopia de microondas revelam que a ligação dupla pode ser acomodada no anel sem distorção grave. O comprimento da ligação C(1)-C(2) é a 1,335 Å, e o ângulo de ligação C(1)-C(2)-C(3) é de 123o. Os substituintes em C(3) e C(6) são denominados como pseudo-axial e pseudo-equatorial.[17]

Efeito de substituintes polares
- O cis-ciclohexano-1,3-diol prefiere a conformação diaxial por formação de uma ligação de hidrogênio intramolecular.
- O 2,5-di-tert-butil-1,4-cicloexanodiol se apresenta em conformação de bote ou bote torcido devido a que também forma uma ligação de hidrogênio intramolecular.
- A 2-bromocicloexanona prefere um Br axial, porque se minimiza a repulsão dipolar.
- A 2-bromo-4,4-dimetilcicloexanona prefere um Br equatorial (com interação diaxial 1,3) mais que uma repulsão dipolar:
- O trans-1,2-dibromocicloexano se apresenta em forma axial em solventes não polares, dado que os dipolos se cancelam, enquanto que em posição equatorial em solventes polares, dado que os dipolos se reforçam.
Notas
- ↑ Esta historia é resumida em artigo constante no archive.org (em Inglés).
Referências
- ↑ BARREIRO, E.J.; FRAGA, C.A.M. Química Medicinal: As bases Moleculares da Ação dos Fármacos. Porto Alegre: Artmed, 2008. 536p.
- ↑ CLAYDEN, J. GREEVES, N., WARREN, S., WOTHERS, P. Organic Chemistry. Oxford: Oxford University Press, 2001. 1512p.
- ↑ FOYE, W.O.; LEMKE, T.L.; WILLIAMS, D.A. Principles of Medicinal Chemistry. Baltimore: Lippincott Williams & Wilkins, 1995. 995p.
- ↑ LEDNICER, D. Strategies for Organic Drug Synthesis and Design. New York: John Wiley & Sons, 1998. 502p.
- ↑ LEDNICER, D. The Organic Chemistry of Drug Synthesis. New Jersey: John Wiley & Sons, 2008, Vol. 07. 272p.
- ↑ MARTINS, A.S., LEMOS, R.C., REZENDE, J.V., KLIER, A.H., OLIVEIRA, C.T.B., ANDRADE, R.J. Uma Nova Ferramenta virtual útil para o ensino de Geometria molecular e Momento Dipolar. Revista de Iniciação Científica Newton Paiva, 116-129, 2008-2009.
- ↑ SOLOMONS, T.W.G. Organic Chemistry. New York: John Wiley & Sons, 1996.1218p.
- ↑ H. Sachse, Chem. Ber, 1890, 23, 1363; Z. Physik. Chem, 1892, 10, 203; Z. Physik. Chem., 1893, 11, 185-219.
- ↑ E. Mohr, J. Prakt. Chem., 1918, 98, 315 and Chem. Ber., 1922, 55, 230.
- ↑ Conformational Study of cis-1,4-Di-tert-butylcyclohexane by Dynamic NMR Spectroscopy and Computational Methods. Observation of Chair and Twist-Boat Conformations Gill, G.; Pawar, D. M.; Noe, E. A J. Org. Chem. (Article); 2005; 70(26); 10726-10731. DOI: 10.1021/jo051654z Abstract
- ↑ Chiralane - chiral 2 - www.mazepath.com
- ↑ Chiralane - chiral 3 - www.mazepath.com
- ↑ North, M. (1998). Principles and applications of stereochemistry. Cheltenham: Thornes. ISBN 0-7487-3994-7
- ↑ a b c Eliel, Ernest L; Wilen, Samuel H. (1994). Stereochemistry Of Organic Compounds. New York: John Wiley and Sons. p. 597-611. ISBN 0-471-01670-5
- ↑ a b Juaristi, E.; Stefani, H. (2012). Introdução à Estereoquímica e á análise conformacional. [S.l.: s.n.]
- ↑ Anderson, J. (1974). «Interconversion of Six-membered Rings». Top. Curr. Chem. 45: 139
- ↑ a b Eliel, Ernest L; Wilen, Samuel H. (1994). Stereochemistry Of Organic Compounds. New York: John Wiley and Sons. p. 597-611. ISBN 0-471-01670-5
Ligações externas
[editar | editar código-fonte]- Animação em aplicativo de Java de cicloexano, mostrando conformações distintas, pela Universidade de Nijmegen