Nitrato cérico de amônio
Este artigo não está em nenhuma categoria. (Julho de 2024) |
Nitrato cérico de amônio ou Nitrato de amônio cérico (também conhecido pela sigla em inglês CAN - para cerium (IV)-ammonium nitrate) é o composto inorgânico com a fórmula (NH
4)
2[Ce(NO
3)
6]''";. Este sal de cério solúvel em água, vermelho-alaranjado, é um agente oxidante especializado em síntese orgânica e um oxidante padrão em análise quantitativa.
| Nitrato cérico de amônio Alerta sobre risco à saúde | |
|---|---|

| |
| Nome IUPAC | Hexanitrato de cério(IV) e diamônio |
| Outros nomes | Hexanitratocerato(IV) de diamônio |
| Identificadores | |
| Número CAS | |
| PubChem | |
| Número EINECS | |
| ChemSpider | |
| SMILES |
|
| InChI | 1/Ce.6NO3.2H3N/c;6*2-1(3)4;;/h;;;;;;;2*1H3/q+4;6*-1;;/p+2
|
| Propriedades | |
| Fórmula química | H8CeN8O18 |
| Massa molar | 548.13 g mol-1 |
| Aparência | Cristais vermelho-alaranjados |
| Ponto de fusão |
107 - 108 °C, 272 K, -55 °F |
| Solubilidade em água | 141 g/100 mL (25 °C) 227 g/100 mL (80 °C) |
| Estrutura | |
| Estrutura cristalina | monoclínico |
| Geometria de coordenação |
icosaedro |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
Preparação, propriedades e estrutura[editar | editar código-fonte]
O ânion [Ce(NO3)6]2− é gerado pela dissolução de Ce2O3 em ácido nítrico quente e concentrado (HNO3).[1]
O sal consiste no ânion hexanitratocerato(IV) [Ce(NO3)6]2− e um par de cátions amônio NH4+. Os íons de amônio não estão envolvidos nas reações de oxidação deste sal. No ânion, cada grupo nitrato quela o átomo de cério de forma bidentada, conforme mostrado abaixo:
O ânion [Ce(NO3)6]2− tem simetria molecular Th (O h idealizado ) . O núcleo CeO12 define um icosaedro.[3]
Ce4+ é um forte agente oxidante de um elétron . Em termos de seu potencial redox (E° ≈ 1,61 V vs. NHE) é um agente oxidante ainda mais forte que Cl2 (E° ≈ 1,36 V). Poucos reagentes estáveis em prateleira são oxidantes mais fortes. No processo redox Ce(IV) é convertido em Ce(III), uma mudança de um elétron, sinalizada pelo desbotamento da cor da solução de laranja para um amarelo claro (desde que o substrato e o produto não sejam fortemente coloridos).
Aplicações em química orgânica[editar | editar código-fonte]
Na síntese orgânica, o CAN é útil como um oxidante para muitos grupos funcionais (álcoois, fenóis e éteres), bem como ligações C–H, especialmente aquelas que são benzílicas. Os alcenos sofrem dinitroxilação, embora o resultado seja dependente do solvente. As quinonas são produzidas a partir de catecóis e hidroquinonas e até mesmo os nitroalcanos são oxidados.[4][5]
CAN fornece uma alternativa à reação Nef; por exemplo, para síntese de cetomacrolida onde reações colaterais complicadas geralmente são encontradas usando outros reagentes. A halogenação oxidativa pode ser promovida por CAN como um oxidante in situ para bromação benzílica e a iodação de cetonas e derivados de uracila.
Para a síntese de heterociclos[editar | editar código-fonte]
Quantidades catalíticas de CAN aquoso permitem a síntese eficiente de derivados de quinoxalina. Quinoxalinas são conhecidas por suas aplicações como corantes, semicondutores orgânicos e agentes de clivagem de DNA. Esses derivados também são componentes de antibióticos como equinomicina e actinomicina. A reação de três componentes catalisada por CAN entre anilinas e éteres alquilvinílicos fornece uma entrada eficiente em 2-metil-1,2,3,4-tetra-hidroquinolinas e as quinolinas correspondentes obtidas por sua aromatização.
Como reagente de desproteção[editar | editar código-fonte]
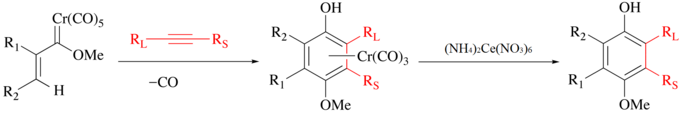
O CAN é tradicionalmente usado para liberar ligantes orgânicos de carbonilas metálicas. No processo, o metal é oxidado, o CO é liberado e o ligante orgânico é liberado para manipulação posterior.[6] Por exemplo, com a reação de Wulff-Dötz, um alcino, monóxido de carbono e um carbeno de crômio são combinados para formar um complexo de meio sanduíche de crômio[7][8][9] e o ligante fenol pode ser isolado por oxidação suave do CAN.
CAN é usado para clivar éteres para- metoxibenzílicos e 3,4-dimetoxibenzílicos, que são grupos protetores para álcoois.[10][11] Dois equivalentes de CAN são necessários para cada equivalente de éter para-metoxibenzílico. O álcool é liberado, e o éter para-metoxibenzílico se converte em para-metoxibenzaldeído. A equação balanceada é a seguinte:
- 2 [NH
4]
2[Ce(NO
3)
6] + H
3COC
6H
4CH
2OR + H
2O → 4 NH+
4 + 2 Ce3+ + 12 NO–
3 + 2 H+
+ H
3COC
6H
4CHO + HOR
Outras aplicações[editar | editar código-fonte]
O CAN também é um componente do agente de corrosão do cromo,[12] um material usado na produção de fotomáscaras e telas de cristal líquido. [carece de fontes]c
Referências
- ↑ Smith, G.Frederick (junho de 1963). «An improved preparation of ammonium hexanitratocerate(IV) and routine analytical testing procedure to prove primary reference standard purity». Talanta (em inglês). 10 (6): 709–710. doi:10.1016/0039-9140(63)80093-4
- ↑ «CSD Entry 1598999, ICSD Entry 22219, H8CeN8O18». Cambridge Crystallographic Data Centre. Cambridge Structural Database: Access Structures. Consultado em 5 de novembro de 2021
- ↑ a b Thomas A. Beineke; J. Delgaudio (1968). «Crystal structure of ceric ammonium nitrate». Inorg. Chem. 7 (4): 715–721. OSTI 4799348. doi:10.1021/ic50062a020
- ↑ Nair, Vijay; Deepthi, Ani (2007). «Cerium(IV) Ammonium NitrateA Versatile Single-Electron Oxidant». Chemical Reviews. 107 (5): 1862–1891. PMID 17432919. doi:10.1021/cr068408n
- ↑ Sridharan, Vellaisamy; Menéndez, J. Carlos (2010). «Cerium(IV) Ammonium Nitrate as a Catalyst in Organic Synthesis». Chemical Reviews. 110 (6): 3805–3849. PMID 20359233. doi:10.1021/cr100004p
- ↑ L. Brener, J. S. McKennis, and R. Pettit "Cyclobutadiene in Synthesis: endo-Tricyclo[4.4.0.02,5]deca-3,8-diene-7,10-dione" Org. Synth. 1976, 55, 43.doi:10.15227/orgsyn.055.0043
- ↑ L. Brener, J. S. McKennis, and R. Pettit "Cyclobutadiene in Synthesis: endo-Tricyclo[4.4.0.02,5]deca-3,8-diene-7,10-dione" Org. Synth. 1976, 55, 43.doi:10.15227/orgsyn.055.0043
- ↑ Waters, M.; Wulff, W. D. (2008). «The Synthesis of Phenols and Quinones via Fischer Carbene Complexes». Organic Reactions. 70 (2): 121–623. doi:10.1002/0471264180.or070.02
- ↑ Dötz, K. H. (1983). «Carbon–Carbon Bond Formation via Carbonyl-Carbene Complexes». Pure and Applied Chemistry. 55 (11): 1689–1706. doi:10.1351/pac198355111689

- ↑ Boons, Geert-Jan.; Hale, Karl J. (2000). Organic Synthesis with Carbohydrates (1st ed.) Sheffield, England: Sheffield Academic Press. pp.33
- ↑ Kocienski, Phillip J. (1994). Protecting Groups Stuttgart, New York Georg Thieme Verlag. pp 8–9, 52–54
- ↑ Walker, Perrin; William H. Tarn (1991). CRC Handbook of Metal Etchants. [S.l.: s.n.] pp. 287–291. ISBN 0-8493-3623-6 Verifique o valor de
|url-access=limited(ajuda)