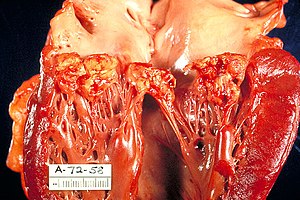
Endocardite infecciosa
| Endocardite infeciosa | |
|---|---|
| Vegetação da válvula mitral causada por endocardite bacteriana | |
| Sinónimos | Endocardite bacteriana |
| Especialidade | Cardiologia, infectologia |
| Sintomas | Febre, pontos vermelhos de sangue na pele, sopro cardíaco, cansaço, anemia[1] |
| Complicações | Insuficiência valvular, insuficiência cardíaca, AVC, insuficiência renal[1][2] |
| Causas | Infeção bacteriana, infeção fúngica[1] |
| Fatores de risco | Valvulopatias incluindo doenças reumáticas, cardiopatia congénita, próteses valvulares, hemodiálise, consumo de drogas intravenosas, pacemakers[3] |
| Método de diagnóstico | Baseado nos sintomas, hemocultura, ecografia[1] |
| Tratamento | Antibiótico, cirurgia cardiovascular[1] |
| Prognóstico | Risco de morte: 25%[3] |
| Frequência | 5 em 100 000 por ano[3] |
| Classificação e recursos externos | |
| CID-9 | 136.9 |
| MedlinePlus | 000681 |
Endocardite infeciosa é uma infeção da superfície interna do coração, geralmente as válvulas cardíacas.[1] Os sintomas mais comuns são febre, pontos vermelhos de sangue na pele, sopro cardíaco, cansaço e anemia.[1] Entre as possíveis complicações estão insuficiência valvular, insuficiência cardíaca, AVC e insuficiência renal.[1][2]
A endocardite infeciosa é geralmente causada por uma infeção bacteriana ou, ainda que menos comum, por uma infeção fúngica.[1] Entre os fatores de risco estão valvulopatias incluindo doenças reumáticas, cardiopatia congénita, próteses valvulares, hemodiálise, consumo de drogas intravenosas e pacemakers.[3] As bactérias implicadas mais comuns são estreptococos ou estafilococos.[1] O diagnóstico pode ser suspeito com base nos sintomas e confirmado com hemoculturas ou ecografia.[1] Existe também uma forma de endocardite não infeciosa.[1]
Os benefícios da administração de antibióticos a seguir a intervenções dentárias como forma de prevenção de endocardite não são ainda claros.[4] Algumas orientações recomenda-nos para grupos de elevado risco.[1] O tratamento geralmente consiste na administração de antibióticos por via intravenosa.[1] A escolha dos antibióticos baseia-se nos resultados da hemocultura.[1] Em alguns casos pode ser necessária cirurgia cardiovascular.[1]
A doença afeta anualmente 5 em cada 100 000 pessoas.[3] No entanto, a frequência varia conforme a região do mundo.[3] A doença é mais frequente entre homens do que entre mulheres.[1] O risco de morte entre pessoas infetadas é de cerca de 25%.[3] Sem tratamento, a doença é quase sempre fatal.[1]
Causas[editar | editar código-fonte]
Num indivíduo saudável, uma bacteremia (onde as bactérias entram na corrente sanguínea através de um pequeno corte ou ferida), normalmente, seria rapidamente eliminada, sem consequências adversas. Se uma válvula cardíaca é danificada ou coberta por um coágulo de sangue, a válvula proporciona um local para que as bactérias se instalem e uma infecção pode ser estabelecida, causando a endocardite infecciosa.
A infecção frequentemente produz vegetações, que são estruturas compostas de plaquetas, fibrina e microrganismos infecciosos. O aspecto da vegetação à ecocardiografia é de uma massa de material ecogênico, aderida a uma superfície endocárdica, geralmente anormal (valvas alteradas, locais de shunts, etc), e que apresenta uma mobilidade diferente da mobilidade da superfície à qual está aderida. Localiza-se geralmente na câmara para onde se dirige a regurgitação (face atrial na valva mitral e ventricular na valva aórtica) e tende a crescer nos folhetos das próteses biológicas e no anel das próteses mecânicas.[5] Nas valvas, ela pode se limitar às cúspides, mas pode invadir o anel ou as estruturas adjacentes, causando distúrbios de ritmo, comunicações entre as cavidades ou mesmo grandes abscessos. Ela pode acometer a valva mitral, a aórtica, a tricúspide ou a pulmonar e, com freqüência, lesando mais de uma. O acometimento pode ser por bactérias gram+, gram – ou por fungos.[6] Atualmente, alterações valvares degenerativas e próteses, e não mais a doença reumática, representam as causas mais comuns de endocardite em países desenvolvidos.[5]
Portanto, o conceito antigo de que a endocardite ocorria quase que exclusivamente em portadores de valvulopatias, já não se aplica e, cada vez mais, a endocardite é diagnosticada em pacientes com outros quadros.[5] Reumatismo crônico, que foi um fator de risco principal na época pré-antibióticos, é agora rara em países industrializados . Este grupo de pacientes em situação de risco, no entanto, foi substituído por um novo grupo de risco, que inclui usuários de drogas intravenosas(com os Estafilococos aureus despontando como causa crescente de endocardite), pessoas idosas com esclerose de válvula, pacientes com próteses intravasculares, aqueles expostos a doença nosocomiais e hemodiálise. No passado, a bacteremia causada por procedimentos dentários (na maioria dos casos por estreptococos viridans, que residem na cavidade oral) era clinicamente mais significativo do que realmente é hoje. No entanto, é importante que um dentista esteja ciente de quaisquer problemas do coração antes de iniciar o tratamento. Outras condições que resultam em elevado número de bactérias que entram na corrente sanguínea incluem câncer colorretal (principalmente Streptococcus bovis), graves infecções do trato urinário e injeção de drogas (Staphylococcus aureus), sendo grande a incidência em usuários de drogas injetáveis, que tendem a ter suas válvulas cardíacas do lado direito infectadas. Com um grande número de bactérias, mesmo uma válvula cardíaca normal, podem ficar infectadas.
Embora tenha havido variações entre o estudos que foram revisados , Staphylococcus aureus e Streptococcus são responsável pela maioria dos casos de doença. Staphylococcus tende a prevalecer, identificando a flora da pele como uma importante fonte de infecção. Notamos também outras associações, como a Streptococcus bovis associada endocardite infecciosa (principalmente Streptococcus gallolyticus) em populações de idosos, e Streptococcus bovis foi frequentemente ligado ao sistema digestivo.
Fisiopatologia[editar | editar código-fonte]
O evento primário é a aderência das bactérias às válvulas danificadas. Este evento é concluído em poucos minutos durante a bacteremia transitória e envolve a válvula de tecido. A segunda etapa envolve a persistência e crescimento de bactérias dentro da lesão cardíaca, geralmente associada com a extensão e ao dano do tecido local. Disseminação de êmbolos sépticos vai tomando espaço em outros órgãos, como por exemplo o rim, baço e cérebro.[7]
Lesões mecânicas[editar | editar código-fonte]
Qualquer escoriação do endotélio resulta em um contato direto entre o sangue e os componentes subendoteliais do “hospedeiro”, incluindo as proteínas extracelular da matriz, tromboplastina e o tecido, que desencadeiam coagulação do sangue. O coágulo que se forma sobre o endotélio danificado, contém grandes quantidades de fibrinogénio- fibrina, fibronectina, as proteínas do plasma e proteínas de plaquetas. Patógenos associados à endocardite infecciosa avidamente ligam-se a estas estruturas e colonizam-se durante a bacteremia transitória. Por sua vez, as bactérias aderentes atraem e ativam monócitos do sangue para produzir mais tecido, assim como a citocina. Citocinas e fatores pró-coagulantes contribuem para o alargamento dos coágulos infectados, denominado de vegetação. Este processo fornece um nicho para os micróbios. Lesões de válvulas mecânicas promovem a infecção por todos os agentes patogênicos classicamente associados com endocardite infecciosa, incluindo estafilococos, estreptococos, e enterococci.[7]
Lesões inflamatórias[editar | editar código-fonte]
As células endoteliais respondem a inflamação local, através de várias moléculas, incluindo integrinas da família B1. Integrinas são proteínas de adesão, presentes na membrana que podem se conectar com o citoesqueleto. Integrinas da família B1 possuem fibronectina na superfície endotelial. Staphylococcus aureus e alguns outros agentes patogênicos infecciosos estão associados a endocardite e transportam proteínas fibronectina de ligação em sua superfície. Assim, fibronectina vinculada sobre o endotélio apresenta uma superfície adesiva para circulação de estafilococos. Uma vez aderido, staph aureus consegue escapar das defesas do hospedeiro e agentes antibacterianos, e multiplicar-se, espalhando-se para órgãos distantes. Este comportamento é orquestrada por reguladores globais, como agr (gene acessório regulador) e SAR (Staphylococcal acessório regulador), que sente a densidade bacteriana e libera ou não a secreção de hemolisinas e toxinas a fim decompletar a invasão.[7]
Staphylococcus aureus está associado à endocardite infecciosa em pacientes sem doença valvar previamente conhecido, e é freqüentemente responsável pela doença em usuários de drogas intravenosas. A válvula de inflamação pode surgir em situações clínicas complicadas, que são suscetíveis a deposição local de fibronectina. Por exemplo, até 25% de pacientes com mais de 40 anos têm lesões degenerativas de válvula e inflamação local, que se assemelha a arterosclerose. De forma similar, contínuas injeções com materiais tóxicos usadas por usuários de drogas, podem incentivar e promover a produção de citocinas, o que causa lesões inflamatórias, especialmente nas válvulas do lado direito.[7]
Características dos microorganismos[editar | editar código-fonte]
Os organismos mais frequentemente responsáveis por endocardite infecciosa são aqueles que possuem a maior capacidade de aderência a válvulas danificadas. Juntos, Staph aureus, Streptococcus spp e enterococos são responsáveis por mais de 80% de todos os casos da doença. Estes organismos têm adesinas de superfície que se apegam à vegetação. Estas adesinas são conhecidoas como MSCRAMMs ou componentes da superfície microbiana, que reagem com matriz adesiva das moléculas. No caso do Staph aureus, o fibrinogênio ligado a proteínas, também chamado fator de aglutinação estão envolvidos na colonização da válvula e a infecção.[7]
Persistência bacteriana in situ[editar | editar código-fonte]
Após a colonização da válvula, os microorganismos infecciosos em sua maioria sobrevivem e evitam as defesas do hospedeiro. Um acontecimento chave no processo é a maturação da vegetação, no qual o microrganismos tornam-se totalmente envolvidos. Tanto estafilococos e estreptococos pode desencadear a produção de monócitos no tecido local e induzir a agregação de plaquetas. Induzir a ativação de plaquetas bacterianas é uma faca de dois gumes pois, quando ativadas, as plaquetas liberam proteínas microbicidas, que matam as bactérias, alterando a sua membrana plasmática.[7]
Microorganismos recuperados de pacientes com endocardite infecciosa foram resistente indução de plaquetas, enquanto que as bactérias semelhantes de pacientes com outros tipos de infecção eram suscetíveis às plaquetas. Portanto, patógenos associados à endocardite infecciosa são resistentes a indução de plaquetas, para tirar vantagem do efeito pró-coagulante.[7]
Invasão e disseminação[editar | editar código-fonte]
Invasão tecidual e formação de abscessos são características principais da endocardite infecciosa. Ligado à superfície das adesinas, Staphylococcus aureus produzem uma riqueza de exoenzimas que convertem tecidos do hospedeiro locais em nutrientes para o crescimento bacteriano e exotoxinas que são prejudiciais para o hospedeiro. A atuação desses fatores é controlado pelos reguladores globais e agr e sar e talvez sigB (sigma B) . sar e é ativado em infecções da vegetação.[7]
Além disso, a inativação de agr por mutação ou por agentes bloqueadores diminui grandemente o formação de abscessos subcutâneos. Invasão e disseminação de outros patógenos associados a endocardite infecciosa, provavelmente, segue, cenários semelhantes. No entanto, uma vez que são menos destrutivo do que Staphylococcus aureus eles têm sido menos estudados.[7]
Papel da transição bacteriana[editar | editar código-fonte]
Procedimentos médicocirúrgicos em locais ou materiais sem esterilização podem provocar bacteremia. Tais bacteremias geralmente são de curta duração (1-100 unidades formadoras de colónias por ml de sangue para menos de 10 minutos, no caso de uma extracção dentária). No entanto, eles podem promover a endocardite infecciosa em pacientes com lesão valvar preexistentes. Bacteremia transitória surge espontaneamente durante a mastigação, escovação, e outras atividades normais, o que provavelmente explica por que a maioria dos casos de endocardite infecciosa não são por procedimentos médicos. Bacteremias espontâneas que surgem durante a mastigação podem explicar porque estreptococos orais são predominantes causa da doença. Assim, mesmo se a profilaxia antibiótica durante procedimentos odontológicos foram eficazes, só impede um número limitado de casos. Boa higiene dental é a melhor medida preventiva.[7]
Papel de defesas do hospedeiro[editar | editar código-fonte]
A endocardite infecciosa é mais frequente devido a bactérias gram-positivas do que a gram-negativas bactérias. O C5b-C9 complexo de ataque da membrana, mata as bactérias gram-negativas por perfurarem sua membrana externa enquanto que as bactérias gram-positivas, , são resistentes à tal ataque. Algumas bactérias gram-negativas têm cápsulas espessas que ajudam a resistir morte induzida pelo complemento.
Um importante subgrupo de patógenos das bactérias gram-negativas associado à endocardite infecciosa inclui microorganismos do grupo HACEK assim como P aeruginosa em usuários de drogas intravenosas. Patogenios gram-positivos podem também resistir as defesas do hospedeiro celulares. Elas podem resistir a plaquetária induzida e responder aos anticorpos.[7]
Fatores de risco[editar | editar código-fonte]
Sabemos que na maioria dos casos da doença, estão envolvidas as bactérias staphylococci e streptococci, logo, pacientes que apresentam infecções em suas próteses e apresentam ferimentos, como por exemplo os usuários de próteses com ferimentos na cavidade oral, podem desenvolver a doença.[7] Deste modo, destacamos os seguintes fatores de risco:
- Prolapso da válvula mitral;
- Estenose aórtica senil;
- Insuficiência mitral;
- Pacientes com próteses dentárias;
- Usuários de drogas intravenosas;
- Pacientes com próteses intravasculares;
- Pacientes expostos à doenças nosocomiais;
- Pacientes que realizam hemodiálise
Antes da era dos antibióticos, a cardiopatia reumática crônica era considerado o fator de risco principal para a endocardite infecciosa. Hoje os fatores de risco são considerados em quatro categorias:
Endocardite Infecciosa das Válvulas Naturais[editar | editar código-fonte]
Está associado com doenças congênitas, assim como prolapso de válvula mitral. Apenas pacientes com refluxo de válvula possuem um risco maior de apresentar a doença. Estudos mostram que o prolapso de válvula mitral está associado a um baixo IMC, pressão arterial e de menor prevalência de Diabetes Mellitus. Com isso, pode-se pensar em uma variável cardiovascular protetiva.[7]
Endocardite Infecciosa das Próteses Valvais[editar | editar código-fonte]
As próteses são a principal causa da estenose aórtica senil e do refluxo de válvula que é um fator de risco para a endocardite infecciosa. Muitos dos pacientes com próteses apresentam a patologia e mais da metade desses pacientes tem mais de 60 anos.
Endocardite Infecciosa em usuários de drogas intravenosas[editar | editar código-fonte]
Usuários de drogas injetáveis representam um grupo de risco, devido à doenças cardiovasculares já citadas acima. Os patógenos normalmente se originam da pele, devido ao contato com seringas, muitas vezes infectadas. Nos pacientes infectados pelo vírus HIV, existe uma chance ainda maior de mortalidade e de risco devido à endocardite infecciosa.[7]
Endocardite Infecciosa Nosocomial[editar | editar código-fonte]
Está é uma categoria crescente. É muito frequente a presença de estafilococos e enterococos relacionados com os cateteres ou procedimentos médico-cirúrgicos, podendo desenvolver a patologia devido à infecção. A endocardite nosocomial é muito relevante devido à sua alta taxa de mortalidade.
Outro fator de risco importante da endocardite infecciosa é a hemodiálise. A doença é de duas a três vezes mais freqüente em pacientes em hemodiálise do que em pacientes de diálise peritoneal ou na população em geral. A maioria dos casos é devido ao Staphylococcus aureus.
Diagnóstico[editar | editar código-fonte]
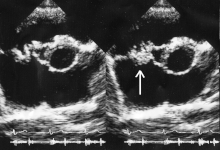
Para que haja um diagnóstico claro da endocardite infecciosa, é necessário que o cardiologista responsável pelo paciente com a suspeita da doença peça exames de sangue e de imagem.[7] Assim, a “American Heart Association”criou uma diretriz, denominada Critérios de Duke[8]:
Critérios de Duke[editar | editar código-fonte]
São necessários para o diagnóstico:
a) 2 critérios maiores ou
b) 1 critério maior e 3 menores ou
c) 5 critérios menores
Critérios maiores[editar | editar código-fonte]
- Isolamento dos agentes típicos de Endocardite Infecciosa em duas hemoculturas distintas, sem foco primário: Streptococcus viridans, Streptococcus bovis, grupo HACEK, Staphylococcus aureus ou bacteremia por enterococo adquirido na comunidade;
- Microorganismo compatível com endocardite infecciosa isolado em hemoculturas persistentemente positivas;
- Única cultura ou sorologia positiva (IgG > 1:800) para Coxiella burnetii
- Nova regurgitação valvar (aparecimento de sopro ou mudança de sopro preexistente não é suficiente);
- Ecocardiograma com evidências de endocardite (há 3 possíveis achados ecocardiográficos: massa intracardíaca oscilante ecogênica em sítio de lesão endocárdica, abscesso perivalvar e nova deiscência em valva prostética)
Critérios menores[editar | editar código-fonte]
- Fator predisponente para doença (uso de drogas injetáveis ou doença cardiovascular predisponente)
- Febre maior que 38oC
- Fenômenos vasculares (exceto petéquias e outras hemorragias)
- Fenômenos imunológicos (presença de fator reumatóide, glomerulonefrite, nódulo de Osler ou manchas de Roth)
- Hemocultura positiva que não preencha critérios maiores ou evidência sorológica de infecção ativa (exclui-se hemocultura única positiva para estafilococo coagulase-negativo ou para microorganismo que raramente cause endocardite)
Condições cardiovasculares de risco para endocardite[editar | editar código-fonte]
Alto Risco[editar | editar código-fonte]
- Valvas protéticas
- Endocardite bacteriana prévia
- Doença congenita cianótica
- Shunts Sistêmico-pulmonares construídos cirurgicamente (Ex: Blalock-Taussig - correção de Tetralogia de Fallot)
- Ducto arterioso patente
- Regurgitação Aórtica
- Estenose Aórtica
- Dupla lesão mitral
- Comunicações interventriculares
- Coarctação da aorta
- Lesões intracardíacas reparadas cirurgicamente, que tenham anormalidade hemodinâmica residual
Risco Intermediário[editar | editar código-fonte]
- Prolapso da valva Mitral, com regurgitação
- Estenose mitral pura
- Doença valvar tricuspide
- Estenose pulmonar
- Hipertrofia Septal assimétrica
- Aorta bicuspide ou esclerose com calcificação aórtica, com anormalidades hemodinâmicas mínimas
- Doença valvar degenerativa do idoso
- Lesão intracardiaca com reparo cirurgico há menos de 6 meses, mesmo sem alterações hemodinamicas residuais.
Risco Baixo ou Nenhum[editar | editar código-fonte]
- Prolapso da valva Mitral, sem regurgitação
- Regurgitação valvar mínima (ex: escape mitral) sem anormalidade estrutural visivel ao ECO
- Defeitos do septo atrial isolados (fossa oval)
- Doença coronariana
- Placas ateroscleróticas
- Marca passos e desfibriladores automáticos implantados
- Cirurgia de revascularização miocardica prévia
- Correção cirúrgica com mais de 6 meses de lesão intra cardiaca, com mínima ou nenhuma alteração hemodinâmica residual.
- Passado de Doença de Kawasaki ou Doença Reumática sem comprometimento valvar.
Prevenção[editar | editar código-fonte]
O regime profilático eficaz no caso da endocardite infecciosa necessita de um equilíbrio, entre os riscos de efeitos colaterais provindos do tratamento e do desenvolvimento da doença.
Há grandes limitações referentes a essa temática devido aos estudos e experiências viáveis e realizadas em animais, estudos randomizados, onde há controle de placebo. Segundo estudos, a profilaxia é eficaz, porém evita um número fechado de casos. Algo que contradiz, é que a principal causa não é por procedimentos cirúrgicos. O que corrobora ainda mais para a prevenção primária, que deve visar o foco na população da construção de hábitos de higiene bucal, por exemplo.[9]
Como a endocardite infecciosa é uma condição associada a alta mortalidade e morbidade, a profilaxia deve seguir procedimento padrão em pacientes de risco, quando forem submetidos a procedimentos médicos, cirúrgicos ou dentários de risco para a doença.
A profilaxia é indicada para pacientes em condições de próteses valvulares, com antecedente de endocardite infecciosa, com cardiopatia congênita, valvopatia reumática, valvopatias adquiridas (doenças degenerativas, p. ex.); a regurgitação mitral; com miocardiopatia hipertrófica.
Há procedimentos, nos quais a profilaxia também é recomendada, como em tratamento e procedimentos dentários nos quais se espera sangramento da mucosa ou gengiva, cirurgia que envolve mucosas respiratórias ou intestinal, tonsilectomia e/ou adenoidectomia, cirurgia de próstata, de vias biliares ou histerectomia vaginal, escleroterapia de varizes esofagianas, dilatação do esôfago, dilatação uretral; parto vaginal na presença de infecção, incisão e drenagem de tecido infectado.[9]
Tratamento[editar | editar código-fonte]
Endocardite aguda[editar | editar código-fonte]
É uma emergência infecciosa, inicia-se rapidamente a terapêutica antibiótica empírica
Utiliza-se geralmente vancomicina e ceftriaxona IV via infusões até que a identificação microbiana e susceptibilidade apresentem concentração inibitória mínima, assim torna possível a modificação da condução do tratamento, a terapia antimicrobiana, pois permitir atingir o microrganismo alvo específico.[9]
Contextualiza-se que a utilização da gentamicina para tratar endocardite não é tão favorável quanto se pensava, devido a ausência de provas para apoiar a sua utilização, com uma exceção, quando há infecções provocadas por Enterococcus e variante estreptococos), neste caso há elevada taxa de complicações.
Endocardite subaguda[editar | editar código-fonte]
Neste caso, o estado hemodinâmico do paciente apresenta-se na maioria dos casos como estável. Há a administração de antibióticos, com duração longa, sendo de duas a seis semanas conforme a características da infecção e do microrganismo causador do desenvolvimento da doença, neste período procura-se identificar este microrganismo.
O organismo mais comum responsável pela endocardite infecciosa é Staphylococcus aureus, que apresenta alta resistência à penicilina, em sua maioria, sem necessária à substituição pela cefalotina, a alta resistência também com o fármaco oxacilina o que exige tratamento com vancomicina, que é administrada em casos de origem hospitalar por S. epidermidis.
A terapia anticoagulante não é recomendada, pois os anticoagulantes podem aumentar a probabilidade de culminar em hemorragia intracerebral, além de não previnem embolização na endocardite infecciosa, não sendo, portanto, usados rotineiramente no tratamento de endocardite. Porém, há pacientes que podem fazer uso de anticoagulante, devido a prótese valvar. Neste caso, o anticoagulante pode ser mantido, sendo necessário acompanhamento cuidadoso. Caso haja sinais de comprometimento do sistema nervoso central, é de caráter urgencial a suspensão da terapia anticoagulante.
Fora à endocardite aguda e subaguda, há a endocardite causada por várias infecções, como pelo Viridans estreptococos do grupo Streptococcus bovis que tem característica sensível à penicilina, sendo utilizada terapia com penicilina ou ceftriaxona juntamente com um aminoglicósidio durante a fase inicial do tratamento, cerca de duas semanas.
Já as cepas resistentes à penicilina de estreptococos do grupo viridans, nutricionalmente variante estreptococos como Granulicatella sp., Gemella sp. e Abiotrophia defectiva e enterococos são normalmente tratados com uma terapia de combinação, sendo penicilina e um aminoglicósidio durante quatro a seis semanas.[9]
Tratamento cirúrgico[editar | editar código-fonte]
Essa intervenção reduz a incidência de mortalidade de pacientes com endocardite infecciosa que evoluem com ICC refratária, acometimento perivalvar com abscessos ou mesmo devido à doença não controlada, apesar do tratamento farmacológico à base de antibióticos adequados e em doses elevadas. Assim, os indivíduos que se encaixam neste perfil devem ser encaminhados para uma avaliação visando à cirurgia cardiovascular. Ressalta-se que indivíduos com próteses não é descartada a intervenção cirúrgica, sendo também necessário a avaliação para este procedimento.
A cura[editar | editar código-fonte]
Para ter sob controle, após o término da terapia antibiótica e/ou intervenção cirúrgica, faz-se preciso o controle com coleta de hemocultura (exame que investiga bactérias no sangue), tendo assim, o quadro sob controle de cura e detecção de reincidência.
Endocardite Infecciosa em Idosos[editar | editar código-fonte]
Com o aumento da população idosa, há o surgimento da prevalência e a maior disposição de aparecimento de diversas doenças, entre elas, podemos destacar a endocardite infecciosa, que atualmente torna-se mais prevalente em idosos comparados a adultos jovens. Idosos que são acometidos com essa doença observa-se que a mortalidade chega até 50% dos casos.[10]
O autor Carvalho Filho (2003),[11] relata que os fatores que propiciam a manifestação dessa doença nos indivíduos idosos são: “valvopatias, próteses valvares, implante de marcapasso, diabetes mellitus, neoplasias, infecções crônicas e manipulações de focos infecciosos com finalidade diagnóstica e/ou terapêutica”.
O autor ainda relata, que quando observado esse tipo de paciente vulnerável a esses fatores de riscos, é de extrema importância submete-los a profilaxia antibiótica. O autor cita American Heart Association, essa associação recomenda o uso de fármacos em algumas situações especificas quando idosos estão acometidos a focos infecciosos. Quando o idoso for submetido a alguma manipulação dentária e do trato respiratório alto, em que o germe Streptococcus vividans é mais frequente, recomenda-se a utilização de amoxacilina na dose de 2,0 g via oral uma hora antes da manipulação. Na ocorrência de manipulações urinárias e intestinais, em que o germe frequente é o Enterococcus faecalis, utiliza-se, na profilaxia, a ampicilina na dose de 2,0g via IM ou IV associada à gentamicina na dose de 1,5 mg por kg de peso (até o máximo de 120 mg) via IM, 30 minutos antes do procedimento e ampicilina 1,0g via IM ou IV seis horas após.
A maior ocorrência desta doença cardíaca em pacientes idosos dá-se principalmente no tratamento odontológico, que pode promover um alto risco a vida desses indivíduos. Mediante a esse cenário e os fármacos mencionados anteriormente, é de extrema relevância a prescrição de antimicrobianos objetivando prevenir bacteremias antes de procedimentos odontológicos que podem desencadear sangramento da mucosa.[12][13]
Epidemiologia[editar | editar código-fonte]
Antigamente os estudos epidemiológicos envolvendo a endocardite infecciosa encontravam barreiras para serem concretizados, como a raridade da doença, a ausência da definição do caso e por não serem oficialmente registradas, fazendo com que os pesquisadores baseassem seus estudos em autópsias. Porém, em uma documentação epidemiológica entre 1993 e 2003 foi encontrado a descrição de 3.784 casos da doença. Nesses casos a média de idade encontrada variava entre 36 anos e 69 anos.[7] Sabe-se que antigamente a faixa etária média para a doença era entre 30 – 40 anos, mas tem aumentado para 47-69 anos, devido o aumenta da longevidade e o tratamento médico, o que representa uma mudança nos dados, devido o aumento de pacientes idosos e contribuindo para a diminuição de casos relacionados à endocardite infecciosa por streptococcus oral,[14] o índice médio da doença para indivíduos com idade inferior a 50 anos foi de 3,6 de 100.000 e variava de 5 a 15 de 100.000 por ano em indivíduos com idade acima dos 65 anos.[7] Além disso a epidemiologia da doença é complexa devido às diferentes características clínicas da população estudada.
A endocardite infecciosa é letal caso não seja tratada com antibióticos, e o índice de mortalidade da doença antes da terapia com antibióticos alcançava 100%, e, atualmente, mesmo com a terapia antibiótica, a taxa permanece elevada em torno dos 25%.[14] A taxa de mortalidade intrahospitalar chega a ser de 16% dos casos atendidos.[7] Apesar das melhorias na saúde e as formas de tratamento terem melhorado o diagnóstico e o prognóstico, a incidência da doença não diminui ao longo dos anos, devido a uma evolução progressiva dos fatores de risco.[5] Cerca de 70% a 75% dos indivíduos com endocardite infecciosa tem história de cardiopatia.[15]
A incidência da doença se dá na faixa de 11 a 50 casos por 1 milhão de habitantes por ano, sendo nos EUA 1,7 a 4,9 casos por 100.000 habitantes.[16] A incidência entre homem - mulher também aparece nos estudos com uma relação média de dois casos para um, respectivamente.
Referências
- ↑ a b c d e f g h i j k l m n o p q r «Infective Endocarditis – Cardiovascular Disorders». Merck Manuals Professional Edition (em inglês). Setembro de 2017. Consultado em 11 de dezembro de 2017
- ↑ a b Njuguna B, Gardner A, Karwa R, Delahaye F (fevereiro de 2017). «Infective Endocarditis in Low- and Middle-Income Countries». Cardiology Clinics. 35 (1): 153–163. PMID 27886786. doi:10.1016/j.ccl.2016.08.011. hdl:1805/14046
- ↑ a b c d e f g Ambrosioni J, Hernandez-Meneses M, Téllez A, Pericàs J, Falces C, Tolosana JM, Vidal B, Almela M, Quintana E, Llopis J, Moreno A, Miro JM (maio de 2017). «The Changing Epidemiology of Infective Endocarditis in the Twenty-First Century». Current Infectious Disease Reports. 19 (5). 21 páginas. PMID 28401448. doi:10.1007/s11908-017-0574-9
- ↑ Cahill TJ, Harrison JL, Jewell P, Onakpoya I, Chambers JB, Dayer M, Lockhart P, Roberts N, Shanson D, Thornhill M, Heneghan CJ, Prendergast BD (junho de 2017). «Antibiotic prophylaxis for infective endocarditis: a systematic review and meta-analysis» (PDF). Heart. 103 (12): 937–944. PMID 28213367. doi:10.1136/heartjnl-2015-309102
- ↑ a b c d Barbosa M.M. Endocardite infecciosa: Perfil clínico em evolução. Arq Bras Cardiol, vol 83, nº3, setembro, 2004.
- ↑ Remsey E S & Lytle B W – Repair of fungal aortic prosthetic valve endocarditis associated with periannular abscess. J Heart Valve Dis 1998; 7: 235-9
- ↑ a b c d e f g h i j k l m n o p q r Moreillon P, Que Y. Infective endocarditis. 2004
- ↑ Baddour et al. Diagnosis, Antimicrobial Therapy, and Management of Complications: A Statement for Healthcare Professionals From the Committee on Rheumatic Fever, Endocarditis, and Kawasaki Disease, Council on Cardiovascular Disease in the Young, and the Councils on Clinical Cardiology, Stroke, and Cardiovascular Surgery and Anesthesia, American Heart Association—Executive Summary: Endorsed by the Infectious Diseases Society of America. Circulation. 2005;111:3167-3184
- ↑ a b c d Silva, V. M. F. Q. Endocardite infecciosa. Disponível em: http://www.fmt.am.gov.br/manual/endocardite.htm
- ↑ Stamboulian, D. Carbone E. Recognition, management and prophylaxis of endocarditis. Drugs 1997; 54:730-44.
- ↑ Carvalho Filho, E.T. Medicina preventiva no idoso. Rev.bras.clín.ter: 29(1):8-18, jan. 2003
- ↑ Lira, R. B.; Silva, S. C. Avaliação clínica da doença periodontal em pacientes com endocardite infecciosa. Rev Periodontia SOBRAPE, São Paulo, v. 11, n. 2, p. 31-35, mar. 2001.
- ↑ Silva, E.M.M; Gallo, A.K.G; Santos, D.M.; Barão, V.A.R.; Freitas Junior, A.C. Enfermidades do Paciente Idoso. Pesq Bras Odontoped Clin Integr, João Pessoa, v. 7, n. 1, p. 83-88, jan./abr. 2007
- ↑ a b Rocha C.A.S., Rocha M.S., Sprovieri S.R.S. O que há de novo na profilaxia da endocardite bacteriana. Deve-se mudar a conduta atual? Rev Bras Clin Med; 7:418-421, 2009.
- ↑ Rombaldi A.R. Endocardite Infecciosa na gravidez. Arq Bras Cardiol; 93 (6 supl. 1): e110-e178, 2009.
- ↑ Gutierrez P., Calderaro D., Caramelli B. Endocardite Infecciosa. Rev Assoc Med Bras; 50(2): 109-26, 2004.
Bibliografia[editar | editar código-fonte]
- Andrade E.D., Passeri L.A., Mattos Filhos T.R. Prevenção da endocardite bacteriana - Novas recomendações da American Heart Association.
- Arq. Bras. Cardiol. vol.83 no.3 São Paulo Sept. 2004. Disponível em: http://dx.doi.org/10.1590/S0066-782X2004001500002
- Baddour et al. Diagnosis, Antimicrobial Therapy, and Management of Complications: A Statement for Healthcare Professionals From the Committee on Rheumatic Fever, Endocarditis, and Kawasaki Disease, Council on Cardiovascular Disease in the Young, and the Councils on Clinical Cardiology, Stroke, and Cardiovascular Surgery and Anesthesia, American Heart Association—Executive Summary: Endorsed by the Infectious Diseases Society of America. Circulation. 2005;111:3167-3184
- Barbosa M.M. Endocardite infecciosa: Perfil clínico em evolução. Arq Bras Cardiol, vol 83, nº3, setembro, 2004.
- Carvalho Filho, E.T. Medicina preventiva no idoso. Rev.bras.clín.ter: 29(1):8-18, jan. 2003
- Dajani AS, Tauber KA, Wilson W, et al. Prevention of bacterial endocarditis: recommendations by the American Heart Association JAMA. Circulation. 1997;96:358-66.
- Dajani, A.S.; Taubert, K.A.; Wilson, W.; et al. Prevention of bacterial endocarditis. Recommendations by the American Heart Association. JAMA 1997; 277:1794-801.
- Grinberg M., Solimene M.C. Aspectos históricos da endocardit infecciosa. Rev Assoc Med Bras; 57(2):228-233, 2011.
- Gutierrez P., Calderaro D., Caramelli B. Endocardite Infecciosa. Rev Assoc Med Bras; 50(2): 109-26, 2004.
- Hoen B, Alla F, Selton-Suty C, et al. Changing profile of endocarditis, results of a 1 year survey in France. JAMA. 2002;288:75-82.
- Homma S, Grahame-Clarke C. Toward reducing embolic complications from endocarditis. Editorial comment. J Am Coll Cardiol. 2004;42:781-83.
- Lira, R. B.; Silva, S. C. Avaliação clínica da doença periodontal em pacientes com endocardite infecciosa. Rev Periodontia SOBRAPE, São Paulo, v. 11, n. 2, p. 31-35, mar. 2001.
- Moreillon P, Que Y. Infective endocarditis. 2004
- Remsey E S & Lytle B W – Repair of fungal aortic prosthetic valve endocarditis associated with periannular abscess. J Heart Valve Dis 1998; 7: 235-9
- Rocha C.A.S., Rocha M.S., Sprovieri S.R.S. O que há de novo na profilaxia da endocardite bacteriana. Deve-se mudar a conduta atual? Rev Bras Clin Med; 7:418-421, 2009.
- Rombaldi A.R. Endocardite Infecciosa na gravidez. Arq Bras Cardiol; 93 (6 supl. 1): e110-e178, 2009.
- Silva, V. M. F. Q. Endocardite infecciosa. Disponível em: http://www.fmt.am.gov.br/manual/endocardite.htm
- Silva, E.M.M; Gallo, A.K.G; Santos, D.M.; Barão, V.A.R.; Freitas Junior, A.C. Enfermidades do Paciente Idoso. Pesq Bras Odontoped Clin Integr, João Pessoa, v. 7, n. 1, p. 83-88, jan./abr. 2007
- Stamboulian, D. Carbone E. Recognition, management and prophylaxis of endocarditis. Drugs 1997; 54:730-44.