Azul de bromotimol
| Azul de bromotimol Alerta sobre risco à saúde | |
|---|---|
| |

| |
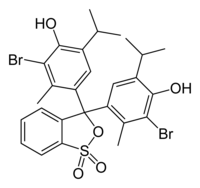
| Nome IUPAC | 4,4'-(1,1-dioxido-3H-2,1-benzoxathiole-3,3-diyl)bis(2-bromo-6-isopropyl-3-methylphenol) |
| Identificadores | |
| Número CAS | |
| PubChem | |
| SMILES |
|
| Propriedades | |
| Fórmula química | C27H28Br2O5S |
| Massa molar | 624.35 g mol-1 |
| Densidade | 1.25 g/cm3 |
| Ponto de fusão |
202 °C, 475 K, 396 °F |
| Acidez (pKa) | 7.10 |
| Compostos relacionados | |
| Indicadores de PH relacionados | Fenolftaleína Azul de bromofenol |
| Compostos relacionados | Vermelho de bromofenol (sem os grupos metil- e isopropil- nos bromofenóis) Azul de timol (sem Br) |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
O azul de bromotimol (BTB, a partir de seu nome na língua inglesa bromothymol blue) é um indicador de pH que em solução ácida fica amarelo, em solução básica fica azul e em solução neutra fica verde.
Azul de bromotimol atua como um ácido fraco em solução. Pode então se apresentar na forma protonada ou deprotonada, amarela e azul, respectivamente.
É tipicamente vendido na forma de um sólido como sal de sódio do indicador ácido.
Seu pKa é 7.10.
É levemente solúvel em água, solúvel em álcool e em soluções aquosas de álcalis. Também é solúvel em éter etílico. Menos solúvel em benzeno, tolueno e xileno. Praticamente insolúvel em éter de petróleo.
Usos[editar | editar código-fonte]
É um indicador adequado para determinações de ácidos e bases fracos, preferencialmente em pH próximo de 7.
Uma de suas aplicações típicas como indicador é a determinação de pH de aquários, tanques de peixes e águas de criadouros e de mares
É também usado para observação de atividade fotossintéticas ou indicar respiração, pois torna-se amarelo na presença de CO2, assim como presença de ácido carbônico dissolvido em água, oriundo da dissolução do CO2.[1][2]
Encontra também uso ocasional em laboratório como um corante biológico para microscopia em lâminas. Neste uso é normalmente azul, e uma gota ou duas de sua solução são usadas em uma lâmina com água. A lamínula é colocada sobre o topo da gota de água e o espécime, com o corante misturado. É algumas vezes usado para definir paredes celulares ou núcleos sob o microscópio.
Esta aplicação como corante microscópio encontra uso na determinação de fosfatidilcolina em líquido amniótico com a predição da síndrome de angústia respiratória.[3]
É usado em obstetrícia para a detecção de rompimento prematuro de membranas. O líquido amniótico geralmente tem um pH> 7,2 , o azul de bromotimol, portanto, torna-se azul quando em contato com vazamento de fluido a partir do âmnio. Como o pH vaginal normalmente é ácido, a cor azul indica a presença de líquido amniótico. O ensaio pode ser falso-positivo na presença de outras substâncias alcalinas, tais como sangue, sémen, ou na presença de vaginose bacteriana.[4]
A razão de área de esfingomielina, determinada com a ajuda do azul de bromotimol permite a determinação de lecitina no líquido amniótico, relacionada com gestações complicadas pelo diabetes.[5]
Cores do indicador[editar | editar código-fonte]


| Azul de bromotimol (indicador de pH) | ||
| pH abaixo de 6.6 | pH acima de 7.6 | |
| amarelo | ⇌ | azul |
Preparação da solução do indicador[editar | editar código-fonte]
Solução aquosa a 0,4%[editar | editar código-fonte]
Esta solução é do sal sódico do indicador para uso em titulações e determinação colorimétrica de pH.
Tritura-se em um gral de vidro limpo 0,4 gramas do indicador com 6,4 ml de solução de hidróxido de sódio a 0,1 M (4 g por litro). Dilui-se esta mistura a 1 litro com água deionizada ou destilada.[6]
Outras formulações recomendadas incluem dissolução de 0,10 g em 8.0 mL de NaOH N/50 (0,8 g por litro) e diluição com água a 250 mL, para uso como indicador de pH, e solução para uso como indicador em trabalho volumétrico, dissolvendo 0,1 g em 100 mL de etanol 50% (v/v).[7]
Referências
- ↑ Sabnis R. W. (2007). Handbook of Acid-Base Indicators. [S.l.]: CRC Press. ISBN 0849382181
- ↑ Sabnis R. W. (2010). Handbook of Biological Dyes and Stains: Synthesis and Industrial Applications 1st ed. [S.l.]: Wiley. ISBN 0470407530
- ↑ John Torday, Ph.D., Linda Carson, B.S., and Edward E. Lawson, M.D.; Saturated Phosphatidylcholine in Amniotic Fluid and Prediction of the Respiratory-Distress Syndrome; N Engl J Med 1979; 301:1013-1018.
- ↑ B. Martinez de Tejada, M. Boulvain, P. Dumps, P. Bischof, A. Meisser, O. Irion; Short communication: Can we improve the diagnosis of rupture of membranes? The value of insulin-like growth factor binding protein-1; BJOG: An International Journal of Obstetrics & Gynaecology, Volume 113, Issue 9, pages 1096–1099, September 2006 - DOI: 10.1111/j.1471-0528.2006.01028.x
- ↑ C. R. Whitfield, W. B. Sproule, M. Brudenell; THE AMNIOTIC FLUID LECITHIN : SPHINGOMYELIN AREA RATIO (LSAR) IN PREGNANCIES COMPLICATED BY DIABETES; BJOG: An International Journal of Obstetrics & Gynaecology, Volume 80, Issue 10, pages 918–922, October 1973 - DOI: 10.1111/j.1471-0528.1973.tb02152.x
- ↑ Mendham, J.; Denney, R.C.; Barnes, J.D. & Thomas, M.J.K. - Vogel: Análise Química Quantitativa. 4a. edição (Traduzido por Aïda Espinola, COPPE - UFRJ), Rio de Janeiro, Guanabara Dois (1981), 690pp
- ↑ O'Neil, Maryadele J (2006). The Merck Index. [S.l.]: Merck Research Laboratory. 1445 páginas. ISBN 978-0-911910-00-1
Ver também[editar | editar código-fonte]
Ligações externas[editar | editar código-fonte]
- «J.T.Baker MSDS» (em inglês)
- «Bromothymol Blue (Sodium Salt) -Sigma Aldrich» (em inglês)
