Atrofia muscular espinhal: diferenças entre revisões
Etiqueta: Inserção de predefinição obsoleta |
|||
| Linha 35: | Linha 35: | ||
}} |
}} |
||
<!-- Definição e sintomas --> |
<!-- Definição e sintomas --> |
||
'''Atrofia muscular espinhal''' é um grupo de [[doenças neuromusculares]] que resultam da perda dos [[Neurónio motor|neurónios motores]] e progressiva [[atrofia muscular]].<ref name=NIH2019>{{citar web|título=Spinal muscular atrophy |url=https://rarediseases.info.nih.gov/diseases/7674/spinal-muscular-atrophy |website=Genetic and Rare Diseases Information Center (GARD) – an NCATS Program |acessodata=27 de maio de 2019}}</ref> A gravidade dos sintomas e a idade de início variam consoante o tipo.<ref name=NIH2019/> Alguns tipos são aparentes durante ou antes do nascimento, enquanto outros só se tornam aparentes em idade adulta.<ref name=NIH2019/> Todos os tipos geralmente resultam em fraqueza muscular progressiva associada a [[fasciculação]].<ref name=NIH2019/><ref name=NINDS2019>{{citar web|título=Spinal Muscular Atrophy Fact Sheet {{!}} National Institute of Neurological Disorders and Stroke |url=https://www.ninds.nih.gov/Disorders/Patient-Caregiver-Education/Fact-Sheets/Spinal-Muscular-Atrophy-Fact-Sheet |website=NINDS |acessodata=27 de maio de 2019}}</ref> Os primeiros músculos a ser afetados são geralmente os dos braços, pernas ou [[músculos da respiração|da respiração]].<ref name=NINDS2019/><ref name=GHR2019>{{citar web|título=Spinal muscular atrophy |url=https://ghr.nlm.nih.gov/condition/spinal-muscular-atrophy |website=Genetics Home Reference |acessodata=27 de maio de 2019 |língua=en}}</ref> Entre outros problemas associados estão dificuldade em engolir, [[escoliose]] e [[Contratura|contraturas das articulações]].<ref name=NORD2019/><ref name=GHR2019/> A atrofia muscular espinhal é uma das principais causas genéticas de morte em [[recém-nascido]]s.<ref name=FDA2019/> |
'''Atrofia muscular espinhal''' (AME)é um grupo de [[doenças neuromusculares]] que resultam da perda dos [[Neurónio motor|neurónios motores]] e progressiva [[atrofia muscular]].<ref name=NIH2019>{{citar web|título=Spinal muscular atrophy |url=https://rarediseases.info.nih.gov/diseases/7674/spinal-muscular-atrophy |website=Genetic and Rare Diseases Information Center (GARD) – an NCATS Program |acessodata=27 de maio de 2019}}</ref> A gravidade dos sintomas e a idade de início variam consoante o tipo.<ref name=NIH2019/> Alguns tipos são aparentes durante ou antes do nascimento, enquanto outros só se tornam aparentes em idade adulta.<ref name=NIH2019/> Todos os tipos geralmente resultam em fraqueza muscular progressiva associada a [[fasciculação]].<ref name=NIH2019/><ref name=NINDS2019>{{citar web|título=Spinal Muscular Atrophy Fact Sheet {{!}} National Institute of Neurological Disorders and Stroke |url=https://www.ninds.nih.gov/Disorders/Patient-Caregiver-Education/Fact-Sheets/Spinal-Muscular-Atrophy-Fact-Sheet |website=NINDS |acessodata=27 de maio de 2019}}</ref> Os primeiros músculos a ser afetados são geralmente os dos braços, pernas ou [[músculos da respiração|da respiração]].<ref name=NINDS2019/><ref name=GHR2019>{{citar web|título=Spinal muscular atrophy |url=https://ghr.nlm.nih.gov/condition/spinal-muscular-atrophy |website=Genetics Home Reference |acessodata=27 de maio de 2019 |língua=en}}</ref> Entre outros problemas associados estão dificuldade em engolir, [[escoliose]] e [[Contratura|contraturas das articulações]].<ref name=NORD2019/><ref name=GHR2019/> A atrofia muscular espinhal é uma das principais causas genéticas de morte em [[recém-nascido]]s.<ref name=FDA2019/> |
||
<!-- Causa e diagnóstico --> |
<!-- Causa e diagnóstico --> |
||
| Linha 42: | Linha 42: | ||
<!-- Tratamento, prognóstico e epidemiologia --> |
<!-- Tratamento, prognóstico e epidemiologia --> |
||
O tratamento consiste em cuidados de apoio, como a [[fisioterapia]], apoio nutritivo e [[ventilação mecânica]] nos casos em que é necessária.<ref name=NIH2019/> O [[nusinersen]], administrado por [[injeção intratecal]], atrasa a progressão da doença e melhora a função muscular.<ref name=NIH2019/><ref name=NINDS2019/> Em 2019, foi aprovada nos Estados Unidos a [[terapia genética]] [[onasemnogene abeparvovec]] para o tratamento de crianças com menos de 24 meses.<ref name=FDA2019>{{citar web|título=FDA approves innovative gene therapy to treat pediatric patients with spinal muscular atrophy, a rare disease and leading genetic cause of infant mortality |url=https://www.fda.gov/news-events/press-announcements/fda-approves-innovative-gene-therapy-treat-pediatric-patients-spinal-muscular-atrophy-rare-disease |website=FDA |acessodata=27 de maio de 2019 |língua=en |data=24 de maio de 2019}}</ref> O prognóstico varia consoante o tipo, desde uma [[esperança de vida]] de apenas alguns meses até fraqueza muscular ligeira com esperança de vida normal.<ref name=GHR2019/> A condição afeta 1 em cada {{formatnum:10000}} nascimentos.<ref name=NORD2019>{{citar web|título=Spinal Muscular Atrophy |url=https://rarediseases.org/rare-diseases/spinal-muscular-atrophy/ |website=NORD (National Organization for Rare Disorders) |acessodata=27 de maio de 2019}}</ref> |
O tratamento consiste em cuidados de apoio, como a [[fisioterapia]], apoio nutritivo e [[ventilação mecânica]] nos casos em que é necessária.<ref name=NIH2019/> O [[nusinersen]], administrado por [[injeção intratecal]], atrasa a progressão da doença e melhora a função muscular.<ref name=NIH2019/><ref name=NINDS2019/> Em 2019, foi aprovada nos Estados Unidos a [[terapia genética]] [[onasemnogene abeparvovec]] para o tratamento de crianças com menos de 24 meses.<ref name=FDA2019>{{citar web|título=FDA approves innovative gene therapy to treat pediatric patients with spinal muscular atrophy, a rare disease and leading genetic cause of infant mortality |url=https://www.fda.gov/news-events/press-announcements/fda-approves-innovative-gene-therapy-treat-pediatric-patients-spinal-muscular-atrophy-rare-disease |website=FDA |acessodata=27 de maio de 2019 |língua=en |data=24 de maio de 2019}}</ref> O prognóstico varia consoante o tipo, desde uma [[esperança de vida]] de apenas alguns meses até fraqueza muscular ligeira com esperança de vida normal.<ref name=GHR2019/> A condição afeta 1 em cada {{formatnum:10000}} nascimentos.<ref name=NORD2019>{{citar web|título=Spinal Muscular Atrophy |url=https://rarediseases.org/rare-diseases/spinal-muscular-atrophy/ |website=NORD (National Organization for Rare Disorders) |acessodata=27 de maio de 2019}}</ref> |
||
==Administração== |
|||
===Medicação=== |
|||
[[Nusinersen]] (Spinraza) é usado para tratar a atrofia muscular espinhal.<ref name="FDA Spinraza label">{{cite web | title=Spinraza- nusinersen injection, solution | website=DailyMed | date=30 de junho de 2020 | url=https://dailymed.nlm.nih.gov/dailymed/drugInfo.cfm?setid=dd70cd5f-b0fc-4ba4-a5ea-89a34778bd94 | access-date=29/10/2020}}</ref> É um nucleotídeo antisenso que modifica o [[splicing alternativo]] do gene SMN2.<ref name="FDA Spinraza label" /> É administrado diretamente no [[sistema nervoso central]] por meio de uma [[injeção intratecal]].<ref name="FDA Spinraza label" /><ref>{{cite news|url=https://www.wsj.com/articles/surprise-drug-approval-is-holiday-gift-for-biogen-1482856447|title=Surprise Drug Approval Is Holiday Gift for Biogen|last=Grant|first=Charley|date=2016-12-27|newspaper=The Wall Street Journal|access-date=29/10/2020|issn=0099-9660}}</ref> Nusinersen prolonga a sobrevivência e melhora a função motora em bebês com AME.<ref>{{cite journal | vauthors = Finkel RS, Mercuri E, Darras BT, Connolly AM, Kuntz NL, Kirschner J, Chiriboga CA, Saito K, Servais L, Tizzano E, Topaloglu H, Tulinius M, Montes J, Glanzman AM, Bishop K, Zhong ZJ, Gheuens S, Bennett CF, Schneider E, Farwell W, De Vivo DC | display-authors = 6 | title = Nusinersen versus Sham Control in Infantile-Onset Spinal Muscular Atrophy | journal = New England Journal of Medicine | volume = 377 | issue = 18 | pages = 1723–32 | date = Novembro 2017 | pmid = 29091570 | doi = 10.1056/NEJMoa1702752 | url = https://discovery.ucl.ac.uk/id/eprint/10046147/ }}</ref> <ref>{{Cite journal|last1=Wadman|first1=Renske I.|last2=van der Pol|first2=W. Ludo|last3=Bosboom|first3=Wendy Mj|last4=Asselman|first4=Fay-Lynn|last5=van den Berg|first5=Leonard H.|last6=Iannaccone|first6=Susan T.|last7=Vrancken|first7=Alexander Fje|date=1 de junho de 2020|title=Drug treatment for spinal muscular atrophy types II and III|journal=The Cochrane Database of Systematic Reviews|volume=1|pages=CD006282|doi=10.1002/14651858.CD006282.pub5|issn=1469-493X|pmc=6995983|pmid=32006461}}</ref> Foi aprovado para uso nos EUA em 2016 e para uso na UE em 2017.<ref>{{cite web | title=Spinraza (nusinersen) Injection | website=U.S. [[Food and Drug Administration]] (FDA) | date=18 de janeiro de 2017 | url=https://www.accessdata.fda.gov/drugsatfda_docs/nda/2016/209531Orig1s000TOC.cfm | access-date=29/10/2020}}</ref><ref name="Spinraza EPAR">{{cite web | title=Spinraza EPAR | website=European Medicines Agency (EMA) | url=https://www.ema.europa.eu/en/medicines/human/EPAR/spinraza | access-date=8 de agosto de 2020}}</ref><ref>{{cite news|url=https://www.afp.com/en/news/1315/spinrazar-nusinersen-approved-european-union-first-treatment-spinal-muscular-atrophy|title=Spinraza (Nusinersen) Approved in the European Union as First Treatment for Spinal Muscular Atrophy|date=2017-06-01|access-date=2017-06-01|publisher=Agence France-Presse (AFP)}}</ref> |
|||
[[Onasemnogene abeparvovec]] (Zolgensma) é um tratamento [[terapia gênica]] que usa vírus adeno-associado autocomplementar tipo 9 (scAAV-9) como vetor para entregar o transgene ''SMN1''.<ref>{{cite web|title=Zolgensma 2 x 1013 vector genomes/mL solution for infusion|url=https://www.medicines.org.uk/emc/product/11572/smpc|website=www.medicines.org.uk|access-date=8 de agosto de 2020}}</ref><ref name="FDA Zolgensma label">{{cite web | title=Zolgensma- onasemnogene abeparvovec-xioi kit | website=DailyMed | date=24 de maio de 2019 | url=https://dailymed.nlm.nih.gov/dailymed/drugInfo.cfm?setid=68cd4f06-70e1-40d8-bedb-609ec0afa471 | access-date=29/10/2020}}</ref> A terapia foi aprovada nos EUA em 2019, como uma formulação [[terapia intravenosa | intravenosa]] para crianças com menos de 24 meses de idade.<ref name="FDA2019">{{cite press release|title=FDA approves innovative gene therapy to treat pediatric patients with spinal muscular atrophy, a rare disease and leading genetic cause of infant mortality|url=https://www.fda.gov/news-events/press-announcements/fda-approves-innovative-gene-therapy-treat-pediatric-patients-spinal-muscular-atrophy-rare-disease|website=U.S. [[Food and Drug Administration]] (FDA)|accessdate=27 de maio de 2019|date=24 de maio de 2019}} {{PD-notice}}</ref><ref>{{cite web | title=Zolgensma | website=U.S. [[Food and Drug Administration]] (FDA) | date=24 de maio de 2019 | url=https://www.fda.gov/vaccines-blood-biologics/zolgensma | access-date=8 de agosto de 2020}}</ref>A aprovação na Europa e no Japão foi concedida no ano seguinte.<ref name="Zolgensma EPAR">{{cite web | title=Zolgensma EPAR | website=European Medicines Agency(EMA) | date=24 de março de 2020 | url=https://www.ema.europa.eu/en/medicines/human/EPAR/zolgensma | access-date=29/10/2020}}</ref><ref>{{Cite press release|url=https://www.novartis.com/news/media-releases/novartis-receives-approval-from-japanese-ministry-health-labour-and-welfare-zolgensma-only-gene-therapy-patients-spinal-muscular-atrophy-sma|title=Novartis receives approval from Japanese Ministry of Health, Labour and Welfare for Zolgensma the only gene therapy for patients with spinal muscular atrophy (SMA)|website=Novartis|access-date=29/10/2020}}</ref> |
|||
[[Risdiplam]] (Evrysdi) é um medicamento tomado por via oral na forma líquida.<ref name="FDA risdiplam" /><ref name="Evrysdi label">{{cite web |url=https://www.gene.com/download/pdf/evrysdi_prescribing.pdf | publisher=Genentech | title=Evrysdi (risdiplam) for oral solution | access-date=8 de agosto de 2020}}</ref> É um derivado de [[piridazina]] que funciona aumentando a quantidade de proteína de [[neurônio motor sobrevivente]] funcional produzida pelo gene [[SMN2 | ''SMN2 '']] por meio de ''splicing''.<ref>{{cite web| url=https://smanewstoday.com/rg7916-rg7800-roche-ptc-smaf | title=RG7916 | author=Maria Joao Almeida | publisher=BioNews Services | date=2016-09-08 | access-date=2017-10-08 }}</ref><ref>{{cite journal | vauthors = Zhao X, Feng Z, Ling KK, Mollin A, Sheedy J, Yeh S, Petruska J, Narasimhan J, Dakka A, Welch EM, Karp G, Chen KS, Metzger F, Ratni H, Lotti F, Tisdale S, Naryshkin NA, Pellizzoni L, Paushkin S, Ko CP, Weetall M | display-authors = 6 | title = Pharmacokinetics, pharmacodynamics, and efficacy of a small-molecule SMN2 splicing modifier in mouse models of spinal muscular atrophy | journal = Human Molecular Genetics | volume = 25 | issue = 10 | pages = 1885–1899 | date = Maio de 2016 | pmid = 26931466 | pmc = 5062580 | doi = 10.1093/hmg/ddw062 }}</ref> O Risdiplam foi aprovado para uso médico nos Estados Unidos em agosto de 2020.<ref name="FDA risdiplam">{{cite press release | title=FDA Approves Oral Treatment for Spinal Muscular Atrophy | website=U.S. [[Food and Drug Administration]] (FDA) | date=7 de agosto de 2020 | url=https://www.fda.gov/news-events/press-announcements/fda-approves-oral-treatment-spinal-muscular-atrophy | access-date=7 de agosto de 2020}}</ref> |
|||
Segundo usuários, o medicamento Spinraza é melhor em termos de custo-benefício, os primeiros dois anos de tratamento com Spinraza custam cerca de metade de uma infusão de Zolgensma, mas os tratamentos com Spinraza devem continuar por toda a vida a um custo de $375 mil dólares por ano, as quatro doses iniciais de Spinraza no primeiro ano de tratamento totalizam US$ 750 mil dólares, em um período de 10 anos, a relação custo-benefício do Zolgensma é clara, em termos de qualidade de vida, uma infusão IV de Zolgensma é mais confortável do que várias infusões espinhais de Spinraza a cada ano.<ref>{{Citar web |url=https://www.statnews.com/2019/05/31/spinal-muscular-atrophy-zolgensma-price-critics/ |titulo=I have spinal muscular atrophy. Critics of the $2 million new gene therapy are missing the point |data=2019-05-31 |acessodata=2020-10-29 |publicado=STAT |ultimo=YATES |primeiro=NATHAN}}</ref> |
|||
No Brasil, o Spinraza, de uso contínuo, cada dose sai por R$ 145 mil, esse medicamento é autorizado pela [[Agência Nacional de Vigilância Sanitária]] (Anvisa) e fornecido pelo [[Sistema Único de Saúde]] (SUS), segundo o Ministério da Saúde, o remédio chegou ao Brasil em 30 de outubro de 2019.<ref>{{Citar web |url=https://www.agenciabrasilia.df.gov.br/2020/07/24/governo-vai-propor-isencao-do-icms-de-remedios-para-a-ame/ |titulo=Governo vai propor isenção do ICMS de remédios para a AME |data=2020-07-24 |acessodata=2020-10-29 |publicado=[[Agência Brasil]] |ultimo=Ferraz |primeiro=Renato}}</ref> |
|||
{{Referências|col=2}} |
{{Referências|col=2}} |
||
Revisão das 03h07min de 30 de outubro de 2020
| Atrofia muscular espinhal | |
|---|---|
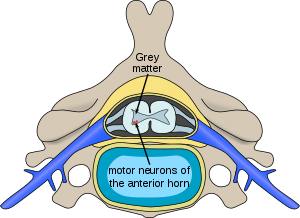
| Localização na medula espinal dos neurónios afetados pela atrofia muscular espinhal | |
| Especialidade | Neurologia |
| Sintomas | Fraqueza muscular progressiva[1] |
| Complicações | Escoliose, contraturas das articulações, pneumonia[2] |
| Tipos | Tipo 0 a tipo 4[2] |
| Causas | Mutação no gene SMN1[2] |
| Método de diagnóstico | Exames genéticos[1] |
| Condições semelhantes | Distrofia muscular congénita, distrofia muscular de Duchenne, síndrome de Prader-Willi[2] |
| Tratamento | Cuidados de apoio, medicação[1] |
| Medicação | Nusinersen, onasemnogene abeparvovec |
| Prognóstico | Difere consoante o tipo[2] |
| Frequência | 1 em 10 000 pessoas[2] |
| Classificação e recursos externos | |
| CID-10 | G12.0-G12.1 |
| CID-9 | 335.0-335.1 |
| OMIM | 253300 253550 253400 271150 |
| DiseasesDB | 14093 |
| MedlinePlus | 000996 |
| eMedicine | article/1181436 article/1264401 article/306812 |
| MeSH | D014897 |
Atrofia muscular espinhal (AME)é um grupo de doenças neuromusculares que resultam da perda dos neurónios motores e progressiva atrofia muscular.[1] A gravidade dos sintomas e a idade de início variam consoante o tipo.[1] Alguns tipos são aparentes durante ou antes do nascimento, enquanto outros só se tornam aparentes em idade adulta.[1] Todos os tipos geralmente resultam em fraqueza muscular progressiva associada a fasciculação.[1][3] Os primeiros músculos a ser afetados são geralmente os dos braços, pernas ou da respiração.[3][4] Entre outros problemas associados estão dificuldade em engolir, escoliose e contraturas das articulações.[2][4] A atrofia muscular espinhal é uma das principais causas genéticas de morte em recém-nascidos.[5]
A doença é causada por um defeito genético no gene SMN1.[1][2] O defeito é herdado de um dos progenitores de forma autossómica recessiva.[1] O gene SMN1 codifica a proteína de sobrevivência dos neurónios motores, uma proteína fundamental para a sobrevivência dos neurónios motores.[4] A perda destes neurónios impede a transmissão de sinais entre o cérebro e os músculos esqueléticos.[4] O diagnóstico é suspeito com base nos sintomas e confirmado por exames genéticos.[1]
O tratamento consiste em cuidados de apoio, como a fisioterapia, apoio nutritivo e ventilação mecânica nos casos em que é necessária.[1] O nusinersen, administrado por injeção intratecal, atrasa a progressão da doença e melhora a função muscular.[1][3] Em 2019, foi aprovada nos Estados Unidos a terapia genética onasemnogene abeparvovec para o tratamento de crianças com menos de 24 meses.[5] O prognóstico varia consoante o tipo, desde uma esperança de vida de apenas alguns meses até fraqueza muscular ligeira com esperança de vida normal.[4] A condição afeta 1 em cada 10 000 nascimentos.[2]
Administração
Medicação
Nusinersen (Spinraza) é usado para tratar a atrofia muscular espinhal.[6] É um nucleotídeo antisenso que modifica o splicing alternativo do gene SMN2.[6] É administrado diretamente no sistema nervoso central por meio de uma injeção intratecal.[6][7] Nusinersen prolonga a sobrevivência e melhora a função motora em bebês com AME.[8] [9] Foi aprovado para uso nos EUA em 2016 e para uso na UE em 2017.[10][11][12]
Onasemnogene abeparvovec (Zolgensma) é um tratamento terapia gênica que usa vírus adeno-associado autocomplementar tipo 9 (scAAV-9) como vetor para entregar o transgene SMN1.[13][14] A terapia foi aprovada nos EUA em 2019, como uma formulação intravenosa para crianças com menos de 24 meses de idade.[5][15]A aprovação na Europa e no Japão foi concedida no ano seguinte.[16][17]
Risdiplam (Evrysdi) é um medicamento tomado por via oral na forma líquida.[18][19] É um derivado de piridazina que funciona aumentando a quantidade de proteína de neurônio motor sobrevivente funcional produzida pelo gene SMN2 por meio de splicing.[20][21] O Risdiplam foi aprovado para uso médico nos Estados Unidos em agosto de 2020.[18]
Segundo usuários, o medicamento Spinraza é melhor em termos de custo-benefício, os primeiros dois anos de tratamento com Spinraza custam cerca de metade de uma infusão de Zolgensma, mas os tratamentos com Spinraza devem continuar por toda a vida a um custo de $375 mil dólares por ano, as quatro doses iniciais de Spinraza no primeiro ano de tratamento totalizam US$ 750 mil dólares, em um período de 10 anos, a relação custo-benefício do Zolgensma é clara, em termos de qualidade de vida, uma infusão IV de Zolgensma é mais confortável do que várias infusões espinhais de Spinraza a cada ano.[22]
No Brasil, o Spinraza, de uso contínuo, cada dose sai por R$ 145 mil, esse medicamento é autorizado pela Agência Nacional de Vigilância Sanitária (Anvisa) e fornecido pelo Sistema Único de Saúde (SUS), segundo o Ministério da Saúde, o remédio chegou ao Brasil em 30 de outubro de 2019.[23]
Referências
- ↑ a b c d e f g h i j k l «Spinal muscular atrophy». Genetic and Rare Diseases Information Center (GARD) – an NCATS Program. Consultado em 27 de maio de 2019
- ↑ a b c d e f g h i «Spinal Muscular Atrophy». NORD (National Organization for Rare Disorders). Consultado em 27 de maio de 2019
- ↑ a b c «Spinal Muscular Atrophy Fact Sheet | National Institute of Neurological Disorders and Stroke». NINDS. Consultado em 27 de maio de 2019
- ↑ a b c d e «Spinal muscular atrophy». Genetics Home Reference (em inglês). Consultado em 27 de maio de 2019
- ↑ a b c «FDA approves innovative gene therapy to treat pediatric patients with spinal muscular atrophy, a rare disease and leading genetic cause of infant mortality». FDA (em inglês). 24 de maio de 2019. Consultado em 27 de maio de 2019 Erro de citação: Código
<ref>inválido; o nome "FDA2019" é definido mais de uma vez com conteúdos diferentes - ↑ a b c «Spinraza- nusinersen injection, solution». DailyMed. 30 de junho de 2020. Consultado em 29 de outubro de 2020
- ↑ Grant, Charley (27 de dezembro de 2016). «Surprise Drug Approval Is Holiday Gift for Biogen». The Wall Street Journal. ISSN 0099-9660. Consultado em 29 de outubro de 2020
- ↑ Finkel RS, Mercuri E, Darras BT, Connolly AM, Kuntz NL, Kirschner J, et al. (Novembro 2017). «Nusinersen versus Sham Control in Infantile-Onset Spinal Muscular Atrophy». New England Journal of Medicine. 377 (18): 1723–32. PMID 29091570. doi:10.1056/NEJMoa1702752
- ↑ Wadman, Renske I.; van der Pol, W. Ludo; Bosboom, Wendy Mj; Asselman, Fay-Lynn; van den Berg, Leonard H.; Iannaccone, Susan T.; Vrancken, Alexander Fje (1 de junho de 2020). «Drug treatment for spinal muscular atrophy types II and III». The Cochrane Database of Systematic Reviews. 1: CD006282. ISSN 1469-493X. PMC 6995983
 . PMID 32006461. doi:10.1002/14651858.CD006282.pub5
. PMID 32006461. doi:10.1002/14651858.CD006282.pub5
- ↑ «Spinraza (nusinersen) Injection». U.S. Food and Drug Administration (FDA). 18 de janeiro de 2017. Consultado em 29 de outubro de 2020
- ↑ «Spinraza EPAR». European Medicines Agency (EMA). Consultado em 8 de agosto de 2020
- ↑ «Spinraza (Nusinersen) Approved in the European Union as First Treatment for Spinal Muscular Atrophy». Agence France-Presse (AFP). 1 de junho de 2017. Consultado em 1 de junho de 2017
- ↑ «Zolgensma 2 x 1013 vector genomes/mL solution for infusion». www.medicines.org.uk. Consultado em 8 de agosto de 2020
- ↑ «Zolgensma- onasemnogene abeparvovec-xioi kit». DailyMed. 24 de maio de 2019. Consultado em 29 de outubro de 2020
- ↑ «Zolgensma». U.S. Food and Drug Administration (FDA). 24 de maio de 2019. Consultado em 8 de agosto de 2020
- ↑ «Zolgensma EPAR». European Medicines Agency(EMA). 24 de março de 2020. Consultado em 29 de outubro de 2020
- ↑ «Novartis receives approval from Japanese Ministry of Health, Labour and Welfare for Zolgensma the only gene therapy for patients with spinal muscular atrophy (SMA)». Novartis (Nota de imprensa). Consultado em 29 de outubro de 2020
- ↑ a b «FDA Approves Oral Treatment for Spinal Muscular Atrophy». U.S. Food and Drug Administration (FDA) (Nota de imprensa). 7 de agosto de 2020. Consultado em 7 de agosto de 2020
- ↑ «Evrysdi (risdiplam) for oral solution» (PDF). Genentech. Consultado em 8 de agosto de 2020
- ↑ Maria Joao Almeida (8 de setembro de 2016). «RG7916». BioNews Services. Consultado em 8 de outubro de 2017
- ↑ Zhao X, Feng Z, Ling KK, Mollin A, Sheedy J, Yeh S, et al. (Maio de 2016). «Pharmacokinetics, pharmacodynamics, and efficacy of a small-molecule SMN2 splicing modifier in mouse models of spinal muscular atrophy». Human Molecular Genetics. 25 (10): 1885–1899. PMC 5062580
 . PMID 26931466. doi:10.1093/hmg/ddw062
. PMID 26931466. doi:10.1093/hmg/ddw062
- ↑ YATES, NATHAN (31 de maio de 2019). «I have spinal muscular atrophy. Critics of the $2 million new gene therapy are missing the point». STAT. Consultado em 29 de outubro de 2020
- ↑ Ferraz, Renato (24 de julho de 2020). «Governo vai propor isenção do ICMS de remédios para a AME». Agência Brasil. Consultado em 29 de outubro de 2020