Cloreto de amónio
Cloreto de Amóniopt, Cloreto de Amôniobr ou ainda sal amoníaco é o composto químico inorgânico de fórmula NH4Cℓ. É um sal cristalino e branco, altamente solúvel em água. Soluções de cloreto de amônio são levemente ácidas. O nome "sal amoníaco" designa a forma natural desse composto, que pode ser encontrada em depósitos minerais. Esse mineral comumente se forma em locais onde a queima de carvão mineral ocasionou a condensação de alguns dos gases eliminados durante a combustão. O mineral também é encontrado nas proximidades de certos eventos vulcânicos. O seu principal uso industrial é como fertilizante, e condimentante em alguns tipos de alcaçuz e vodca. É o produto da reação de amônia com ácido clorídrico.
Ficha Técnica[editar | editar código-fonte]
- Grupo:Halóides
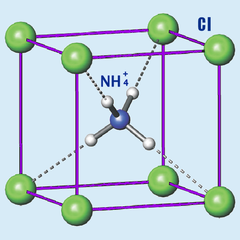
- Sistema cristalino:Isométrico
- Fórmula química:(NH4)Cl
- Dureza:1,5-2 ( escala de Mohs )
- pH: 4,5 - 5,5[5]
- Densidade:1,5
- Clivagem:Octaédrico
- Fratura:Concóide
- Cor: Branco,amarelo ou cinza
- Cor do traço:Branca
- Brilho:Sedoso
- Fluorescência:Ausente
Solubilidade em água:
| Temperatura | Solubilidade (em g/100 g de água) |
|---|---|
| 0 °C | 29,6 |
| 20 °C | 54,6 |
| 40 °C | 57,5 |
| 60 °C | 61,0 |
| 80 °C | 66,1 |
| 100 °C | 73,0 |
Segurança[editar | editar código-fonte]
A substância se decompõe ao ser aquecida intensamente ou ao arder, produzindo fumaça tóxica e irritante de óxidos de nitrogênio, amoníaco e cloreto de hidrogênio. A dissolução em água resulta em um ácido fraco. Reage violentamente com nitrato de amônio e clorato de potássio, originando perigo de incêndio e explosão. Reage com ácidos concentrados formando cloreto de hidrogênio e com bases fortes formando amoníaco. Reage com sais de prata formando compostos sensíveis ao choque (fulminatos). Ataca ao cobre e seus compostos.
Obtenção[editar | editar código-fonte]
Cloreto de amônio é preparado comercialmente pela reação de amônia, NH3, com ácido clorídrico, HCl:
- NH3 + HCl → NH4Cl
Pode ser obtido facilmente em solução, em laboratório, pela reação de amoníaco, com ácido clorídrico:
- NH4OH + HCl → NH4Cl + H2O.
História[editar | editar código-fonte]
O moderno nome "amônio" vem de sal amoníaco. A substância foi conhecida como sal nushadir (Árabe e Persa: نشادر) em países árabes e Pérsia, naosha (chinês: 硇砂, pinyin: náoshā) na China, nao sadar na Índia. Os romanos chamavam os depósitos de cloreto de amônio que eles coletavam próximo ao Templo de Júpiter Amun (grego Ἄμμων Ammon) na Líbia antiga 'sal ammoniacus' (sal de Amun) por causa da proximidade com o templo.[6]
Ele era considerado um dos quatro espíritos da alquimia islâmica [7]. Enquanto o meio pelo que se dissociava em dois materiais corrosivos (amônia e ácido clorídrico) os quais atacam metais convenceram alguns alquimistas de então que ele poderia deter a chave para a conversão de um metal em outro, árabes o usaram[carece de fontes] como uma fonte de amônia:
- 2NH4Cl + 2CaO → CaCl2 + Ca(OH)2 + 2NH3
Aplicações[editar | editar código-fonte]
Cloreto de amônio é vendido em blocos em ferragens para uso em limpeza de solda em ferro e pode ser incluído no processos de solda como um fundente.
Outros usos incluem suplementação alimentar para gado, em xampu para cabelos, em estamparia de têxteis, na colagem e ligação de compensados, e como um ingrediente em meios nutritivos para levedo, em produtos de limpeza, e como medicamento antisussígeno. Sua ação expectorante é causada por ação irritante sobre a mucosa dos brônquios. Isto causa a produção excessiva de fluido do trato respiratório o qual presumivelmente é mais fácil de ser expelido. É também usado em um teste oral para diagnosticar acidose renal tubular distal.
Cloreto de amônio é usado no tratamento de neve, por exemplo em pistas de esqui em temperaturas acima de 0 °C, para endurecer a neve e retardar seu derretimento.[8]
Em diversos países o sal amoníaco é usado para doces com alcaçuz (como o salmiakki da Finlândia, lakrisal da Suécia, zoute drop da Holanda e o Dracula Piller da Dinamarca são exemplos populares), e como um flavorizante para vodcas.
Referências
- ↑ a b c d Registo de CAS RN 12125-02-9 na Base de Dados de Substâncias GESTIS do IFA, accessado em 15 de Agosto de 2007
- ↑ a b Solid state data from Predefinição:Nist
- ↑ PAETEC Formelsammlung Ausgabe 2003, Seite 116
- ↑ (en) « Ammonium chloride » em ChemIDplus
- ↑ «Ficha técnica». Consultado em 21 de agosto de 2017
- ↑ «Ammonia». h2g2 Eponyms. BBB.CO.UK. 11 de janeiro de 2003. Consultado em 8 de novembro de 2007
- ↑ Hassan, Ahmad Y. «Arabic Alchemy: Science of the Art». History of Science and Technology in Islam. Consultado em 29 de março de 2008
- ↑ «www.mpa.cc». Consultado em 19 de fevereiro de 2008. Arquivado do original em 19 de fevereiro de 2008