Cicloexano
| Cicloexano Alerta sobre risco à saúde | |
|---|---|
|

|
| |
| Identificadores | |
| Número CAS | |
| SMILES |
|
| Propriedades | |
| Fórmula molecular | C6H12 |
| Massa molar | 84.16 g/mol |
| Densidade | 0.779 g/ml, líquido |
| Ponto de fusão |
6.5 °C, 280 K, 44 °F |
| Ponto de ebulição |
80.74 °C, 354 K, 177 °F |
| Solubilidade em água | Imiscível |
| Viscosidade | 1.02 cP at 17 °C |
| Termoquímica | |
| Entalpia padrão de formação ΔfH |
-156 kJ/mol |
| Entalpia padrão de combustão ΔcH |
-3920 kJ/mol |
| Riscos associados | |
| Classificação UE | Inflamável (F) Nocivo (Xn) Perigoso para o ambiente (N) Irritante severo dos olhos, pode causar opacificação da córnea |
| NFPA 704 | |
| Frases R | R11, R38, R65, R67, R35 |
| Frases S | S2, S9, S16, S25, S33, S60, S61, S62 |
| Ponto de fulgor | -20 C |
| Compostos relacionados | |
| cicloalcanos relacionados | Ciclopentano Metilcicloexano Ciclo-heptano |
| Compostos relacionados | Cicloexeno Cicloexanol Benzeno Piperidina (anel com 5 carbonos e 1 nitrogênio) |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |

O cicloexano, também grafado como ciclo-hexano, é um composto orgânico formado por 6 átomos de carbono, e 12 átomos de hidrogénio, de fórmula C6H12. Pode derivar da ciclização de compostos alifáticos, ou da redução com hidrogênio na presença de um catalisador e altas pressões de benzeno.
Aplicações
[editar | editar código-fonte]O cicloexano possui várias aplicações das quais se destacam a sua utilização como matéria prima para a produção de 1,6 hexametilenodiamina, ácido adípico e caprolactama.
O cicloexano também é utilizado como matéria-prima para a produção de cicloexanona e cicloexanol, os quais além de serem usados na fabricação de caprolactama e ácidos adipicos, possuem outras diversas aplicações como solvente. Destaca-se uma boa aceitação do cicloexano no processo de desidratação de álcool substituindo o benzeno, com menores problemas de toxicidade em relação a este último.[1]
Distingue-se dentro de seu usos como solvente: betume e cêras, borracha crua, solventes para éteres de celulose, extração de óleos essenciais, gorduras, solvente na indústria de plásticos (especialmente para resinas usadas em revestimentos de fios), óleos, removedor de pintura e verniz.
Outros usos ainda incluem a de nitrocicloexano e de cloreto de cicloexila.
É utilizado ainda na fabricação de combustíveis sólidos para aquecedores, incluindo militares, na formulação de fungicidas e na cristalização de esteróides e derivados.
É utilizado como intermediário para a produção de Ciclo-hexilamina (utilizada como inibidor de corrosão e como composto intermediário para inseticidas, produtos farmacêuticos e tintas), para fabricação de ciclamatos (adoçantes), na produção de acelerador de vulcanização da classe das sulfenamidas e como intermediário na síntese de diversos corantes orgânicos.
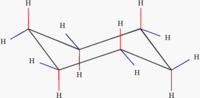
Conformação
[editar | editar código-fonte]O cicloexano não é um um hexágono plano bidimensional, porque os ângulos entre as ligações carbono seria de 120o, superior ao ângulo de 109,5o de um carbono tetraédrico. Outro fator desestabilizante para esta forma seriam as ligações C-H eclipsadas. A conformação do cicloexano é uma estrutura tridimensional conhecida como conformação da cadeira, que rapidamente se converte à temperatura ambiente por meio de um processo conhecido como virar a cadeira.
Durante o giro da cadeira, existem outras três conformações intermediárias encontradas: a meia-cadeira, que é a mais instável, o barco torcido e o barco, menos estável do que a cadeira. A cadeira e o barco torcido são mínimos de energia. Metade dos hidrogênios estão no plano do anel (equatorial), enquanto a outra metade é perpendicular ao plano (axial).
Se o cicloexano for mono-substituído por substituinte, então ocorre um equilíbrio entre duas conformações: uma com o substituinte em axial e outra com o substituinte em equatorial e a diferença de energia é chamada de valor A. Usualmente, a conformação com o substituinte na posição equatorial é mais estável.
Dentre os outros cicloalcanos, o cicloexano apresenta a menor tensão de torção porque o ângulo coincide com 109,5 ° e por isso foi considerado como padrão para determinar a tensão total do anel. A proposta para a conformação da cadeira é a estrutura mais estável para o ciclohexano foi proposta pela primeira vez em 1890 por Hermann Sachse, mas só ganhou ampla aceitação muito mais tarde.
Referências
[editar | editar código-fonte]Ligações externas
[editar | editar código-fonte]- Instituto nacional de Seguridad e Higiene en el Trabajo de España: Ficha internacional de segurança do cicloexano (em espanhol).


