Ácido cloroáurico: diferenças entre revisões
contribuição para o conteúdo - Reações, Obtenção etc |
m +Ligações externas; +ficheiro |
||
| Linha 1: | Linha 1: | ||
{{em tradução|data=Março de 2008}} |
{{em tradução|data=Março de 2008}} |
||
{{Info/Química |
{{Info/Química |
||
| ImageFile = |
| ImageFile = ChloroauricAcid.svg |
||
| ImageSize = |
| ImageSize = 200px |
||
| IUPACName = <!-- ácido tetracloroáurico --> |
| IUPACName = <!-- ácido tetracloroáurico --> |
||
| OtherNames = ácido tetracloroáurico<br />tetracloro aurato(III) de hidrogênio<br />tetracloro aurato |
| OtherNames = ácido tetracloroáurico<br />tetracloro aurato(III) de hidrogênio<br />tetracloro aurato |
||
| Linha 51: | Linha 51: | ||
O tratamento alcalino do ácido cloroáurico, com uma base padrão, resulta na produção de [[sal|sal metálico]] de tetracloro-ouro e água. O respectivo sal de [[tálio]] possui solubilidade baixa na maioria dos solventes. A combinação com amônio ([[sal quaternário de amônio]]) também é conhecida.<ref name="solidcontact">{{citar periódico|último=Makotchenko|primeiro=|coautores=Kokovkin|título=Solid contact [AuCl<sub>4</sub>]<sup>−</sup>-selective electrode and its application for evaluation of gold(III) in solutions|jornal=Russian Journal of General Chemistry|ano=2010|mes=setembro|volume=80|número=9|páginas=1733-1737|doi=10.1134/S1070363210090021|idioma=en|issn=1070-3632}}</ref> Outros sais de forma [[Complexo (química)|complexa]] são: <nowiki>[</nowiki>{{Quim|Au}}[[Piridina|(bi-pir)]]{{Quim|Cl|2}}<nowiki>][</nowiki>{{Quim|Au|Cl|4}}<nowiki>]</nowiki><ref name="x13" >Mironov, Tsvelodub. L. D.; "Equilibria of the substitution of pyridine, 2,2'-Bipyridyl, and 1,10-Phenanthroline for Cl<sup>−</sup> in AuCl<sub>4</sub><sup>−</sup> in aqueous solution", ''Russian Journal of Inorganic Chemistry''. 2001, vol. 46, p. 143–148.</ref> e <nowiki>[</nowiki>{{Quim|Co|(|N|H|3|)|6|<nowiki>][</nowiki>|Au|Cl|4|]|Cl|2}}. |
O tratamento alcalino do ácido cloroáurico, com uma base padrão, resulta na produção de [[sal|sal metálico]] de tetracloro-ouro e água. O respectivo sal de [[tálio]] possui solubilidade baixa na maioria dos solventes. A combinação com amônio ([[sal quaternário de amônio]]) também é conhecida.<ref name="solidcontact">{{citar periódico|último=Makotchenko|primeiro=|coautores=Kokovkin|título=Solid contact [AuCl<sub>4</sub>]<sup>−</sup>-selective electrode and its application for evaluation of gold(III) in solutions|jornal=Russian Journal of General Chemistry|ano=2010|mes=setembro|volume=80|número=9|páginas=1733-1737|doi=10.1134/S1070363210090021|idioma=en|issn=1070-3632}}</ref> Outros sais de forma [[Complexo (química)|complexa]] são: <nowiki>[</nowiki>{{Quim|Au}}[[Piridina|(bi-pir)]]{{Quim|Cl|2}}<nowiki>][</nowiki>{{Quim|Au|Cl|4}}<nowiki>]</nowiki><ref name="x13" >Mironov, Tsvelodub. L. D.; "Equilibria of the substitution of pyridine, 2,2'-Bipyridyl, and 1,10-Phenanthroline for Cl<sup>−</sup> in AuCl<sub>4</sub><sup>−</sup> in aqueous solution", ''Russian Journal of Inorganic Chemistry''. 2001, vol. 46, p. 143–148.</ref> e <nowiki>[</nowiki>{{Quim|Co|(|N|H|3|)|6|<nowiki>][</nowiki>|Au|Cl|4|]|Cl|2}}. |
||
A [[redução]] parcial do ácido produz |
A [[redução]] parcial do ácido produz dicloroaurato(I), {{Quim|[|Au|Cl|2|]|-}} ([[oxônio]] como contra-ião).<ref name=Huang2010>{{Cite journal|last=Huang|first=Xiaohua|author2=Peng, Xianghong |author3=Wang, Yiqing |author4=Yuxiang, Wang |author5=Shin, Dong M. |author6=El-Sayed, Mostafa A. |author7= Nie, Shuming |title=A reexamination of active and passive tumor targeting by using rod-shaped gold nanocrystals and covalently conjugated peptide ligands|journal=ACS Nano|date=26 October 2010|volume=4|issue=10|pages=5887–5896|doi=10.1021/nn102055s|publisher=ACS Publications}}</ref><sup><--- (Ref. ERRADA??)</sup> Através de redução podem também ser produzidos outris compostos de coordenação do ouro(I), especiamente utilizando-se [[ligante]]s orgânicos. Frequentemente o próprio ligante serve como agente redutor, como é no caso da [[tioureia]], {{Quim|(|H|2|N|)|C|S}}: |
||
:<math>\mathrm{AuCl^{-}_4 + 4 (H_2N)_2CS + H_2O \longrightarrow Au[(H_2N)_2CS]^{+}_2 + (H_2N)_2CO + S + 2 Cl^{-} + 2 HCl}</math> |
:<math>\mathrm{AuCl^{-}_4 + 4 (H_2N)_2CS + H_2O \longrightarrow Au[(H_2N)_2CS]^{+}_2 + (H_2N)_2CO + S + 2 Cl^{-} + 2 HCl}</math> |
||
<br /> |
<br /> |
||
O ácido cloroáurico é o composto percursor na preparação de [[Nanopartícula|nanopartículas]] de ouro, |
O ácido cloroáurico é o composto percursor na preparação de [[Nanopartícula|nanopartículas]] de ouro. Para precipitação destas agentes redutores, como por exemplo o [[tiosulfato]] ({{Quim|Na|2|S|2|O|3}}), são usados.<ref>{{citar periódico|título=Tunability and stability of gold nanoparticles obtained from chloroauric acid and sodium thiosulfate reaction|jornal=Nanoscale Research Letters|ano=2012|volume=7|páginas=337|doi=10.1186/1556-276X-7-337|url=http://www.nanoscalereslett.com/content/pdf/1556-276x-7-337.pdf|autor=Zhang ''et al.''}}</ref> |
||
O aquecimento da forma [[Hidrato|hidratada]] ({{Quim|H|Au|Cl|4|•}} ''n'' {{Quim|H|2|O}}) em uma corrente de [[gás cloro]] resulta em cloreto áurico (o cloreto de ouro (III), {{Quim|Au|2|Cl|6}}).<ref name="x5"> Mellor J. W. ''A comprehensive treatise on inorganic and theoretical chemistry''. Vol. 3. 1946. p. 593.</ref> |
O aquecimento da forma [[Hidrato|hidratada]] ({{Quim|H|Au|Cl|4|•}} ''n'' {{Quim|H|2|O}}) em uma corrente de [[gás cloro]] resulta em cloreto áurico (o cloreto de ouro (III), {{Quim|Au|2|Cl|6}}).<ref name="x5"> Mellor J. W. ''A comprehensive treatise on inorganic and theoretical chemistry''. Vol. 3. 1946. p. 593.</ref> |
||
{{Referências}} |
{{Referências}} |
||
== Ligações externas == |
|||
* {{Link |1=en |2=http://www.chm.bris.ac.uk/motm/chloroauric-acid/Chloroauric%20Acid.htm |3=Chloroauric Acid |4=breve texto acadêmico com descrição e ilustrações}} |
|||
{{esboço-composto-inorgânico}} |
{{esboço-composto-inorgânico}} |
||
Revisão das 05h05min de 28 de novembro de 2014
Este artigo ou se(c)ção está a ser traduzido. (Março de 2008) |
| Ácido cloroáurico Alerta sobre risco à saúde | |
|---|---|
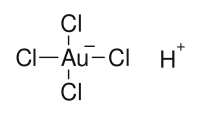
| |
| Outros nomes | ácido tetracloroáurico tetracloro aurato(III) de hidrogênio tetracloro aurato |
| Identificadores | |
| Número CAS | |
| Propriedades | |
| Fórmula molecular | HAuCl4 |
| Massa molar | 339,79 g/mol (forma anidra) 411,85 g/mol (tri-hidrato) |
| Aparência | cristais amarelo ouro higroscópico |
| Densidade | 3,9 g/cm3 (tri-hidrato) |
| Solubilidade em água | solúvel em água |
| Solubilidade | solúvel em álcool, éter |
| Riscos associados | |
| Principais riscos associados |
C |
| Frases R | 34‐43 |
| Frases S | 26‐36/37/39‐45 |
| Compostos relacionados | |
| Compostos relacionados | ácido cloroplatínico |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
Ácido cloroáurico é o composto fórmula química HAuCl4. Ele é normalmente usado como fonte de ouro (Au) em experiências quimicas. O ácido cloroáurico é produto formado ao dissolver ouro em água régia, por exemplo, ao retirar ouro de componentes eletrônicas. O mesmo nome é usado para a forma anidra e para a forma tri-hidratada.
Obtenção e síntese
A maneira mais convencional e trivial de se obter o ácido cloroáurico é a dissolução de ouro elementar em água régia (uma mistura de três partes de ácido clorídrico para uma parte de ácido nítrico):[1]
Uma outra possibilidade é a reação entre cloreto áurico e ácido clorídrico:[1]
Propriedades
Propriedades físicas
Propriedades químicas
Reações
O tratamento alcalino do ácido cloroáurico, com uma base padrão, resulta na produção de sal metálico de tetracloro-ouro e água. O respectivo sal de tálio possui solubilidade baixa na maioria dos solventes. A combinação com amônio (sal quaternário de amônio) também é conhecida.[2] Outros sais de forma complexa são: [Au(bi-pir)Cl2][AuCl4][3] e [Co(NH3)6][AuCl4]Cl2.
A redução parcial do ácido produz dicloroaurato(I), [AuCl2]- (oxônio como contra-ião).[4]<--- (Ref. ERRADA??) Através de redução podem também ser produzidos outris compostos de coordenação do ouro(I), especiamente utilizando-se ligantes orgânicos. Frequentemente o próprio ligante serve como agente redutor, como é no caso da tioureia, (H2N)CS:
O ácido cloroáurico é o composto percursor na preparação de nanopartículas de ouro. Para precipitação destas agentes redutores, como por exemplo o tiosulfato (Na2S2O3), são usados.[5]
O aquecimento da forma hidratada (HAuCl4• n H2O) em uma corrente de gás cloro resulta em cloreto áurico (o cloreto de ouro (III), Au2Cl6).[6]
Referências
- ↑ a b «Gold-Verbindungen». RÖMPP-Online (em alemão). Consultado em 28 de novembro de 2014
- ↑ Makotchenko; Kokovkin (setembro de 2010). «Solid contact [AuCl4]−-selective electrode and its application for evaluation of gold(III) in solutions». Russian Journal of General Chemistry (em inglês). 80 (9): 1733-1737. ISSN 1070-3632. doi:10.1134/S1070363210090021
- ↑ Mironov, Tsvelodub. L. D.; "Equilibria of the substitution of pyridine, 2,2'-Bipyridyl, and 1,10-Phenanthroline for Cl− in AuCl4− in aqueous solution", Russian Journal of Inorganic Chemistry. 2001, vol. 46, p. 143–148.
- ↑ Huang, Xiaohua; Peng, Xianghong; Wang, Yiqing; Yuxiang, Wang; Shin, Dong M.; El-Sayed, Mostafa A.; Nie, Shuming (26 October 2010). «A reexamination of active and passive tumor targeting by using rod-shaped gold nanocrystals and covalently conjugated peptide ligands». ACS Publications. ACS Nano. 4 (10): 5887–5896. doi:10.1021/nn102055s Verifique data em:
|data=(ajuda) - ↑ Zhang; et al. (2012). «Tunability and stability of gold nanoparticles obtained from chloroauric acid and sodium thiosulfate reaction» (PDF). Nanoscale Research Letters. 7. 337 páginas. doi:10.1186/1556-276X-7-337
- ↑ Mellor J. W. A comprehensive treatise on inorganic and theoretical chemistry. Vol. 3. 1946. p. 593.
Ligações externas
- «Chloroauric Acid» (em inglês). breve texto acadêmico com descrição e ilustrações




![{\displaystyle \mathrm {AuCl_{4}^{-}+4(H_{2}N)_{2}CS+H_{2}O\longrightarrow Au[(H_{2}N)_{2}CS]_{2}^{+}+(H_{2}N)_{2}CO+S+2Cl^{-}+2HCl} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/4fe6e9db3613c56f3630dc50fef6861268b1fd4b)